ГИДРОКСИДЫ, неорг. соед. металлов общей ф-лы М(ОН)n, где и-степень окисления металла М. Являются основаниями или амфотерными соединениями. Г. щелочных, щел.-зем. металлов и Тl(I) наз. щелочами,
Кристаллич. решетки Г. щелочных и щел.-зем. металлов содержат ионы ОН-, к-рые легко обнаруживаются по широкой полосе в ИК-спектре при 3600 см-1. Щелочи при растворении в воде подвергаются электролитич. диссоциации с образованием гидратированных ионов ОН " и аквакатионов металла. В конц. неводных р-рах Г. щелочных металлов возможно образование ионных пар, напр. (К + *ОН-), c включением в их состав молекул р-рителя. Г. щелочных металлов хорошо раств. в воде, Г. остальных металлов мало растворимы и часто выделяются из водного р-ра в виде гелей переменного состава, содержащих молекулы воды.
К амфотерным Г. относят Ве(ОН)2, Zn(OH)2, A1(OH)3,
Ga(OH)3, Sn(OH)2, Pb(OH)2, СrO(ОН) и нек-рые
др. При взаимод. с к-тами они образуют соли, с сильными основаниями -гидроксокомплексы,
Напр., Г цинка может реагировать как с к-той, так и с основанием:
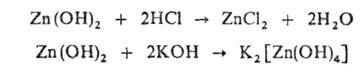
Г. многих металлов, особенно элементов FVб гр. периодич. системы, склонны
к поликонденсации в результате процесса оляции-образования мостиковых групп
ОН (см. Гидроксокомплексы). При этом Г. прсвращ. в сложные нестехиометрич.
соед.-многоядерные гидроксоаквакомплексы, содержащие такие, напр., фрагменты:
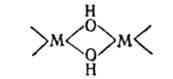
Образованию этих соед. способствует повышение т-ры, концентрации р-ра
и водородного показателя (рН). При старении осадка многоядерных гидроксоаквакомплексов
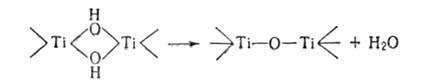
гидроксогруппы необратимо превращ. в оксогруппы (процесс оксоляцииХ напр.:
Многие Г. и их водные р-ры поглощают СО2 из воздуха с образованием карбонатов, с к-тами дают соли. При нагр. Г. щелочных металлов, кроме LiOH, плавятся, а остальные, в т.ч. и LiOH, разлагаются на оксид металла и воду, напр.: Сu(ОН)2 -> СuО + Н2О. Гидроксиды Cu(I), Ag(I), Au(I) разлагаются на воду и оксид в процессе их образования.
Г. щелочных металлов получают: электролизом водных р-ров солей, чаще всего хлоридов; методом ионного обмена с использованием анионитов в ОН-форме; иногда по обменным р-циям, напр.: Li2SO4 + Ва(ОН)2 -> 2L1OH + BaSO4. Г. остальных металлов получают в осн. по обменным р-циям. В отдельных случаях Г. щел.-зем. металлов синтезируют взаимод. их оксидов с водой, напр.: СаО + Н2О -> Са(ОН)2.
Г. встречаются в природе в в.иде минералов, напр. ги-драргиллита А1(ОН)3,
брусита Mg(OH)2. Среди орг. в-в также известны Г., напр. тетраалкиламмо-нийгидроксиды
(NR4)OH, где R = CH3, C2H5;
они хорошо раств. в воде относ. к классу оснований. Б. Д. Степин.


