ГИББСА-ДЮГЕМА УРАВНЕНИЕ, связывает изменения т-ры Т, давления
р и хим. потенциалов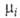 компонентов равновесных термодинамич. систем. В общем виде записывается
в форме:
компонентов равновесных термодинамич. систем. В общем виде записывается
в форме:
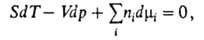
где 5 и К-энтропия и объем системы соотв., ni-число молей
i-того компонента. Для процессов, происходящих при постоянных Т и р,
Г.-Д. у. устанавливает связь между изменениями хим. потенциалов компонентов
и Наиб. широко используется в термодинамике р-ров. Для р-ров неэлектролитов
употребительны след. формы ур-ния:
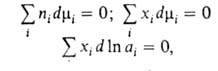
где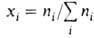 -молярная
доля i-того компонента, аi-его активность, связанная с
-молярная
доля i-того компонента, аi-его активность, связанная с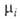 соотношением:
соотношением:
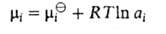
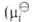 -хим. потенциал
компонента в стандартном состоянии, R-газовая постоянная). Форма
записи Г.-Д.у. для коэффициентов активности
-хим. потенциал
компонента в стандартном состоянии, R-газовая постоянная). Форма
записи Г.-Д.у. для коэффициентов активности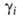 зависит
от способа выражения концентрации (в молярных долях, молярности или моляльности).
При выражении концентрации в молярных долях для р-ров неэлектролитов
зависит
от способа выражения концентрации (в молярных долях, молярности или моляльности).
При выражении концентрации в молярных долях для р-ров неэлектролитов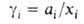 и Г.-Д.у. имеет вид: Для р-ров электролитов разработаны спец. формы
и Г.-Д.у. имеет вид: Для р-ров электролитов разработаны спец. формы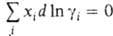 записи Г.-Д. у.
записи Г.-Д. у.
Г.-Д. у. позволяет определять зависимость от состава хим. потенциала, активности или коэф. активности одного из компонентов бинарного р-ра, если подобная зависимость известна для др. компонента (в случае многокомпонентных р-ров-для всех остальных компонентов). Г.-Д. у. применяют также для определения активности компонентов бинарного р-ра по данным о равновесном общем давлении пара над р-ром при данной Т.; с его помощью проверяют термодинамич. согласованность экспериментально определенных значений активности в-в (см. Активность термодинамическая).
Ур-ние предложено Дж. Гиббсом в 1876; его приложения впервые рассмотрены П. Дюгемом (Дюэмом) в 1886.
Лит. см. при статьях Активность, Растворы электролитов, Растворы
неэлектролитов. В. А. Михайлов.


