ГЕКСАФТОРПРОПИЛЕН (перфторпропилен, мономер-6) CF3CF=CF2, мол. м. 150,02; бесцв. газ; т. пл. - 156,2°С, т. кип. -29,4°С; d4-401,565; tкрит 85°C, pкрит3,15 МПа, dкрит0,6 г/см3; давление пара (МПа): 0,102 (-29°С), 0,215 (10°С), 0,613 (20°С), 1,003 (40°С), 1,82 (60°С).
Г.-типичный
представитель перфторолефинов (см. Фторолефины). С нуклеоф. агентами
легко образует продукты замещения и присоединения, напр.:
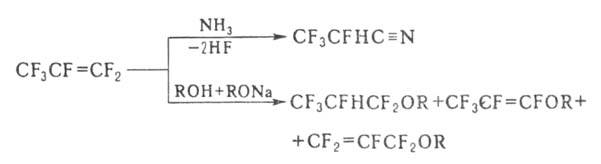
Взаимод.
Г. с ионными фторидами в апротонных полярных р-рителях приводит к аниону
(CF3)2CF, к-рый легко реагирует с электроф. агентами,
напр.:
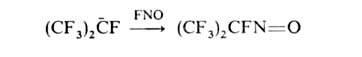
В отсутствие электроф. агентов анион взаимод. с Г., образуя димеры (CF3)2CFCF=CFCF3, (CF3)2C=CFC2F5 и тримеры C9F18 (смесь изомеров).
К Г.
способны присоединяться сильные электрофилы, напр.:
В нек-рых
р-циях образуется промежут. перфтораллильный катион, напр.:
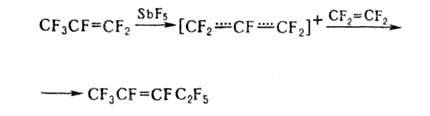
По радикальному
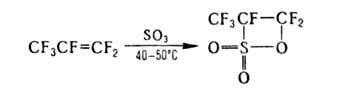
механизму Г. галогенируется, легко присоединяет H2S, NaHSO3,
спирты, простые эфиры (атака направляется на CF2-rpyппy), напр.:
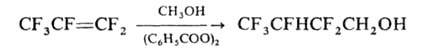
Г. практически не дает гомополимеров. Выше 250 °С в замкнутой системе образует смесь 1,2- и 1,3-перфтордиметилциклобутанов. В р-ции Дильса -Альдера служит диенофилом.
Пром. способ получения Г.: пиролиз тетрафторэтилена при 700-900 °С. Др. способы: пиролиз политетрафторэтилена, декарбоксилирование солей перфтормасляной к-ты.
Г. применяют в синтезе сополимеров с тетрафторэтиленом или винилиденфторидом, а также перфторполиэфиров, гексафторпропиленоксида и др.
Для Г. ПДК 5 мг/м3; летальная концентрация 0,3% по объему (крысы, экспозиция 4 ч). Не образует взрывоопасных смесей с воздухом.
Впервые получен А. Хэнне и Т. Валкесом в 1945.
Лит.:
Кнунянц
И. Л., Полищук В. Р., "Успехи химии", 1976, т. 45, № 7, с. 1139-76; Паншин
Ю. А., Малкевич С. Г., Дунаевская Ц. С., Фторопласты, Л., 1978, с. 6, с.
14-16. Л. С. Герман.


