ГАФНИЙ (от лат. Hafnia-Копенгаген; лат. Hafnium) Hf, хим. элемент IV гр. периодич. системы, ат. н. 72, ат. м. 178,49. Прир. Г. состоит из 6 изотопов с маc. ч. 174 (0,18-0,20%), 176 (5,15-5,30%), 177 (18,39-18,55%), 178 (27,08-27,23%), 179 (13,73-13,84%), 180 (35,07-35,44%). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 105*10-28 м2. Конфигурация внеш. электронной оболочки 5d26s2; степень окисления + 4, редко + 3, + 2; энергия ионизации Hf° -> Hf1+ -> Hf2+ соотв. 723 и 1437 кДж/моль; электроотрицательность по Полингу 1,6; атомный радиус 0,159 нм, ионный радиус Hf4+ 0,082 нм (координац. число 6).
Содержание Г. в земной коре (3-4)*10-4% по массе. Относится к рассеянным элементам. Собственных минералов не имеет, встречается в виде изоморфной примеси в минералах циркония [обычно 1-2% от массы (ZrO2 + HfO2)]. В нек-рых разновидностях циркона (ZrSiO4) содержание Г. выше: в гафниевом цирконе-до 31%, наэгите-до 10%, альвите-до 15%, циртолите-до 24%. В тортвейтите (Y, Sc)Si2O7 цирконий и Hf находятся в виде примесей, причем содержание Г. превосходит содержание Zr. Общие геол. запасы Г. в капиталистич. странах оцениваются в 600 тыс. т.
Свойства.
Компактный Г.-серебристо-серый блестящий металл, порошкообразный - темно-серый,
почти черный, матовый. Ниже 1740°С устойчив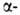 Hf,
решетка гексаген, типа Mg (a = 0,31883 нм, с = 0,50422 нм, пространств.
группа С6/nmc; плотн. 13,350 г/см3); выше 1740°С устойчив
Hf,
решетка гексаген, типа Mg (a = 0,31883 нм, с = 0,50422 нм, пространств.
группа С6/nmc; плотн. 13,350 г/см3); выше 1740°С устойчив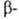 Hf, решетка кубическая типа
Hf, решетка кубическая типа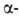 Fе
(а = 0,3615нм, пространств. группа /m3m; плотн. 13,82 г/см3);
Fе
(а = 0,3615нм, пространств. группа /m3m; плотн. 13,82 г/см3);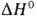 полиморфного перехода 6,7 кДж/моль. Т. пл. ок. 2230 °С, т. кип. ок. 5400°С
(по др. данным ок. 4700°С); Сop 25,7 кДж/(моль*К),
полиморфного перехода 6,7 кДж/моль. Т. пл. ок. 2230 °С, т. кип. ок. 5400°С
(по др. данным ок. 4700°С); Сop 25,7 кДж/(моль*К),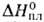 21 кДж/моль,
21 кДж/моль,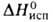 670 кДж/моль (2500 К); So298 43,55 Дж/(моль*К); давление
пара при т-ре плавления 2,80*10-3 Па; температурный коэф. линейного
расширения 5,9*10-6 К-1 (0-1000°С); теплопроводность
22,0 Вт/(м*К) при 100°С;
670 кДж/моль (2500 К); So298 43,55 Дж/(моль*К); давление
пара при т-ре плавления 2,80*10-3 Па; температурный коэф. линейного
расширения 5,9*10-6 К-1 (0-1000°С); теплопроводность
22,0 Вт/(м*К) при 100°С;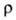 4*10-7
Ом*м (20°С);
4*10-7
Ом*м (20°С);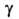 1,46
Н/м (ок. 2230°С); электронная эмиссия 26,2 мА/см2 (2000 К);
работа выхода электрона 3,53 эВ; нормальный электродный потенциал Hf/Hf4+-1,70B.
1,46
Н/м (ок. 2230°С); электронная эмиссия 26,2 мА/см2 (2000 К);
работа выхода электрона 3,53 эВ; нормальный электродный потенциал Hf/Hf4+-1,70B.
Мех.
св-ва Г. в значительной степени зависят от его чистоты и способа обработки.
Так, примеси О2, N2 и С придают Г. хрупкость, облучение
нейтронами увеличивает его твердость; отжиг восстанавливает первоначальные
св-ва. Модуль упругости 137 ГПа, модуль сдвига 30,4 ГПа; коэф. Пуассона
0,328; коэф. сжимаемости 1,18 ГПа (303 К); предел текучести 232 МПа (293
К);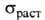 447 МПа (293 К); твердость по Бринеллю 1,1-1,2 ГПа (нагрузка 29430 Н).
447 МПа (293 К); твердость по Бринеллю 1,1-1,2 ГПа (нагрузка 29430 Н).
По хим. св-вам Г. подобен Zr. Компактный Г. не взаимод. с водой при давлении до 25 МПа и т-ре до 400 °С, с парами Н2О реагирует ок. 300 °С. Коррозионная стойкость Г. в воде практически не изменяется даже под действием нейтронного облучения. Компактный металл устойчив на воздухе, не взаимод. с О2. При 500-600°С слабо окисляется и покрывается черным слоем нестехиометрич. оксида; с ростом т-ры скорость окисления увеличивается (выше 700°С образуется НfO2), особенно резко-выше 900-1000 °С. Г. окисляется О2 медленнее, чем Zr.
Г. устойчив в р-рах щелочей и NH3, до 100 °С не взаимод. с НС1, H2SO4 и HNO3 (более стоек, чем Ti), реагирует со смесями минер. к-т, фтористоводородной к-той и кипящей H2SO4. В присут. фторидов щелочных металлов или аммония стойкость Г. к действию минер. к-т снижается.
При нормальной т-ре Г. не взаимод. с N2 и Н2. С азотом при 700-800 °С образует нитрид HfN, с галогенами при 200-400°С-тетрагалогениды, с углеродом при 1800-2000 °С-карбид HfC, с кремнием выше 1000 °С-силициды Hf2Si, Hf5Si3, HfSi и HfSi2; при 350-400 °С поглощает Н2 с образованием гидрида HfH2, выше 400 °С Н2 десорбируется.
Соед. Г. по сравнению с соед. Zr труднее полимеризуются в р-рах и легче восстанавливаются. Г. образует комплексные соед., в к-рых его координац. числа 6-8. В водных р-рах соед. Г. гидролизуются, образуя аквакомплексы, ги-дроксокомплексы, ацидокомплексы, а также смешанные комплексы (напр., фторосульфаты, сульфатокарбонаты). Практически все соед. Г. изоморфны соответствующим соед. Zr; нек-рое различие в их хим. св-вах связано с меньшим радиусом Hf4+ (для Zr4+ 0,087 нм), разными значениями энтальпий гидратации ионов (для Hf4+-7169 кДж/моль, Zr4+ -7001 кДж/моль) и др. Ниже приводятся сведения о наиб. важных соединениях.
Диоксид
НЮ2-белые кристаллы; до 1650°С устойчива модификация с моноклинной
решеткой (а = 0,511 нм, b = 0,514 нм, с = 0,528 нм,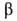 =
99,73°; плотн. 9,68 г/см3); выше 1650°С эта модификация переходит
в тетрагональную (а = 0,514нм, с = 0,525нм; плотн. 10,01 г/см3),
к-рая ок. 2500°С превращ. в кубическую (а = 0,511нм, плотн. 10,43 г/см3);
т. пл. 2780°С; С° 60,2 Дж/(моль*К);
=
99,73°; плотн. 9,68 г/см3); выше 1650°С эта модификация переходит
в тетрагональную (а = 0,514нм, с = 0,525нм; плотн. 10,01 г/см3),
к-рая ок. 2500°С превращ. в кубическую (а = 0,511нм, плотн. 10,43 г/см3);
т. пл. 2780°С; С° 60,2 Дж/(моль*К);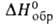 -
1117 кДж/моль,
-
1117 кДж/моль,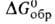 - 1061 кДж/моль; So298 59,3 Дж/(моль*К); не раств.
в воде, не реагирует с конц. НС1 и HNO3, взаимод. с конц. фтористоводородной
к-той, H2SO4, расплавленными щелочами. Получают прокаливанием
гидроксидов Г. или его термически нестойких солей, напр. нитратов. Применяют
для изготовления регулирующих стержней ядерных реакторов и защитных экранов,
как компонент спец. стекол и огнеупоров, в кач-ве добавки (0,1-3%) к W
при изготовлении нитей накаливания электрич. ламп для увеличения срока
их службы.
- 1061 кДж/моль; So298 59,3 Дж/(моль*К); не раств.
в воде, не реагирует с конц. НС1 и HNO3, взаимод. с конц. фтористоводородной
к-той, H2SO4, расплавленными щелочами. Получают прокаливанием
гидроксидов Г. или его термически нестойких солей, напр. нитратов. Применяют
для изготовления регулирующих стержней ядерных реакторов и защитных экранов,
как компонент спец. стекол и огнеупоров, в кач-ве добавки (0,1-3%) к W
при изготовлении нитей накаливания электрич. ламп для увеличения срока
их службы.
Гидроксиды Г.-кристаллич. или гелеобразные соед. переменного состава общей ф-лы НfO2*хН2О; при 200-300 °С разлагаются последовательно до НfO(ОН)2 и НfO2; плохо раств. в воде; подвергаются поликонденсации при старении; амфотерны (преобладают основные св-ва). Получают щелочным гидролизом водных р-ров солей Hf. Гидроксиды Г.-про межу т. продукты при получении соед. Hf.
Тетрафторид
HfF4-белые кристаллы с моноклинной решеткой (а = 1,174
нм, b = 0,991 нм, с = 0,766 нм,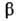 =
= 129,15°, пространств. группа С2с); т. возг. ок. 970 °С, т. пл. ок. 1020°С
(23,8МПа); плотн. 7,130 г/см3; Сop 92
Дж/(моль*К);
=
= 129,15°, пространств. группа С2с); т. возг. ок. 970 °С, т. пл. ок. 1020°С
(23,8МПа); плотн. 7,130 г/см3; Сop 92
Дж/(моль*К);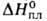 75 кДж/моль,
75 кДж/моль,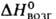 226 кДж/моль (974 °С),
226 кДж/моль (974 °С),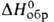 - 1930 кДж/моль,
- 1930 кДж/моль,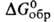 - 1830 к Д ж/моль; So298 из Дж/(молъ*К); не раств.
в воде, на холоду-в неорг. к-тах, хорошо раств. во фтористоводородной к-те,
р-рах фторидов щелочных металлов и аммония; образует кристаллогидраты;
с фторидами металлов дает комплексные соед.-фторогафнаты. Получают термич.
разложением (NH4)2 [HfF6] при 500-600
°С, осаждением из р-ров солей Г. при действии фтористоводородной к-ты,
взаимод. Hf с F2, НfO2 или гидроксидов Г. с F2
или HF.
- 1830 к Д ж/моль; So298 из Дж/(молъ*К); не раств.
в воде, на холоду-в неорг. к-тах, хорошо раств. во фтористоводородной к-те,
р-рах фторидов щелочных металлов и аммония; образует кристаллогидраты;
с фторидами металлов дает комплексные соед.-фторогафнаты. Получают термич.
разложением (NH4)2 [HfF6] при 500-600
°С, осаждением из р-ров солей Г. при действии фтористоводородной к-ты,
взаимод. Hf с F2, НfO2 или гидроксидов Г. с F2
или HF.
Фторогафнаты-бесцв. кристаллич. в-ва состава M[HfF,], M,[HfFJ, M,[HfF7] (М-однозарядный катион) или M[HfF6], M2[HfF8] (М-двухзарядный катион). наиб. важны соед. калия и аммония. Гексафторогафнат калия K2[HfF6] имеет т. пл. 608 °С (с разл.); умеренно раств. в воде (47,5 г/л), хуже-в разбавленных р-рах HF; техн. продукт получают спеканием цирконовых концентратов с K2SiF6, чистый-взаимод. HfF4 с KF в водном р-ре. Гептафторогафнат аммония (NH4)3[HfF7] при 500-600 °С разлагается последовательно до (NH4)2 [HfF6], NH4[HfF5] и HfF4; хорошо раств. в воде; получают взаимод. НfO2 с NH4HF2 при 100-200 °С или HfF4 с NH4F в водном р-ре.
Тетрахлорид
HfCl4-бесцв. кристаллы с кубич. решеткой (а = 1,041 нм);
т. возг. 315 °С, т. пл. 432°С (3,38 МПа): С°p 120,5 Дж/(моль*К);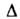 Hoвозг
103 кДж/моль (315°С),
Hoвозг
103 кДж/моль (315°С),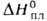 ок. 23 кДж/моль,
ок. 23 кДж/моль,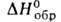 — 991,2 кДж/моль,
— 991,2 кДж/моль,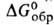 -901,1
кДж/моль; So298 191 Дж/(моль*К); гидролизуется водой;
гигроскопичен; раств. в спирте, расплавленных хлоридах щелочных металлов.
Получают взаимод. Hf с С12 выше 300 °С, смеси НfO2,
С и С12-выше 500 °С
-901,1
кДж/моль; So298 191 Дж/(моль*К); гидролизуется водой;
гигроскопичен; раств. в спирте, расплавленных хлоридах щелочных металлов.
Получают взаимод. Hf с С12 выше 300 °С, смеси НfO2,
С и С12-выше 500 °С
Дитидроксодихлорид Hf(ОН)2С12*7Н2О - бесцв. кристаллы с тетрагон, решеткой; разлагается выше 65 °С; хорошо раств. в воде, спирте и разбавленной соляной к-те; получают растворением гидроксидов Hf в соляной к-те.
Тетраиодид
HfI4-желтовато-оранжевые или коричневые кристаллы с кубич. решеткой;
т. возг. 397 °С, т. пл. 449°С(0,81 МПа), т. разл. ок. 1100°С; С° 121 Дж/(моль*К);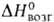 107 кДж/моль (397 °С),
107 кДж/моль (397 °С),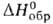 - 589 кДж/моль,
- 589 кДж/моль,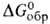 -
583,5 кДж/моль; So298 258 дж/(моль*К); гидролизуется
водой. Получают взаимод. Hf с 12 при 300-500 °С.
-
583,5 кДж/моль; So298 258 дж/(моль*К); гидролизуется
водой. Получают взаимод. Hf с 12 при 300-500 °С.
Сульфат Hf(SO4)2-бесцв. кристаллы; т. разл. ок. 500°С; раств. в воде с гидролизом; гигроскопичен; образует кристаллогидраты (обычно содержат 4 молекулы Н2О), к-рые выше 100 °С начинают обезвоживаться. Безводную соль получают взаимод. НЮ2 или HfCl4 с конц. H2SO4 при нагревании. Известны сульфатогафнаты щелочных металлов и аммония М4 [Hf(SO4)4]*nН2О (и = = 2—7).
Гидроксонитрат Hf(OH)2(NO3)2*Н2О образуется при медленном упаривании азотнокислых р-ров Г. При добавлении небольшого кол-ва воды к моногидрату получают пентагидрат, к-рый при 130 °С теряет 4 молекулы воды. Гидроксонитраты выше 400 °С разлагаются до НfO2.
Нитрид
HfN - золотисто-желтые кристаллы с кубич. решеткой; т. пл. ок. 3300°С;
С° ок. 40 Дж/(моль*К);- 374 кДж/моль,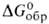 - 346 кДж/моль; So298
- 346 кДж/моль; So298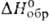 ок. 47 Дж/(моль*К); не раств. в воде, разлагается царской водкой и горячими
конц. неорг. к-тами. Получают взаимод. Hf с N2. Перспективный
материал защитных покрытий на металлах.
ок. 47 Дж/(моль*К); не раств. в воде, разлагается царской водкой и горячими
конц. неорг. к-тами. Получают взаимод. Hf с N2. Перспективный
материал защитных покрытий на металлах.
Карбид
HfC-серые кристаллы с металлич. блеском, решетка кубическая; т. пл. 3890°С
(с разл.); Сop 38,1 Дж/(моль*К);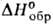 - 227,09 кДж/моль,
- 227,09 кДж/моль,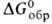 —
205 кДж/моль;So298
40,1 Дж/(моль*К); модуль упругости 514 ГПа, модуль сдвига 225 ГПа; микротвердость
28,30 ГПа; не раств. в воде, разлагается горячей конц. H2SO4
и царской водкой. Получают взаимод. порошкообразного Hf или НfO2
с С. Применяют как компонент керамики и материалов для жаропрочных покрытий,
для изготовления регулирующих стержней ядерных реакторов, буровых инструментов,
в кач-ве добавки к сплавам на основе Mo, W и Re, W и Hf для улучшения их
мех. св-в (
—
205 кДж/моль;So298
40,1 Дж/(моль*К); модуль упругости 514 ГПа, модуль сдвига 225 ГПа; микротвердость
28,30 ГПа; не раств. в воде, разлагается горячей конц. H2SO4
и царской водкой. Получают взаимод. порошкообразного Hf или НfO2
с С. Применяют как компонент керамики и материалов для жаропрочных покрытий,
для изготовления регулирующих стержней ядерных реакторов, буровых инструментов,
в кач-ве добавки к сплавам на основе Mo, W и Re, W и Hf для улучшения их
мех. св-в (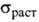 повышается в 6-7 раз).
повышается в 6-7 раз).
Нитрид, карбид и борид Г. обладают высокими элек-трич. проводимостью (металлич. типа), твердостью, хрупкостью. Наиб. тугоплавкие соед.-карбид и нитрид.
Получение. Г. получают попутно с Zr. При переработке циркониевых концентратов соед. Г. отделяют от соед. Zr в основном след. способами: жидкостной экстракцией нитратов Zr трибутилфосфатом или роданидов Г.-метилизобутилкетоном, а также дробной кристаллизацией комплексных фторидов K2[Zr(Hf)F6]. Получаемые при этом концентраты содержат соотв. 20-96% (от суммы Zr + Hf), 25-98% и 6-10% Г. Соед. Zr и Hf м. б., кроме того, разделены экстракцией их сульфатов орг. аминами, ионообменным методом, а также методом солевой ректификации их тетрахлоридов. В последнем случае ректификац. колонну орошают расплавом хлоридов щелочных металлов, а в среднюю ее часть подают смесь паров HfCl4 и ZrCl4; в зависимости от т-ры процесса HfCl4 концентрируется в кубе или в верх. части колонны.
Металлич.
Г. в виде губки получают восстановлением HfCl4 магнием при 500-800
°С; в виде слитка-восстановлением HfF4 кальцием при т-ре выше
2000 °С (иногда в присут. I2 и Zn). Порошкообразный Г. может
быть получен восстановлением НfO2 кальцием при 1300°С или К2
[HfF6] натрием при 800-900 °С. Г. производят также электролизом
смеси K2[HfF6], KC1 и NaCl при ~ 800oС
или расплава HfF4 и КС1 при 700-800 °С. Чистый, пластичный Г.
получают путем хим. транспортной р-ции: Hf ++ 2I2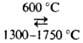 HfI4. Образующийся при этом Г. осаждается на накаленной вольфрамовой
проволоке в виде прутков, к-рые переплавляют в крупные слитки в дуговых
или электроннолучевых печах.
HfI4. Образующийся при этом Г. осаждается на накаленной вольфрамовой
проволоке в виде прутков, к-рые переплавляют в крупные слитки в дуговых
или электроннолучевых печах.
Определение. Г. обнаруживают качественно по слабо-розовой окраске с гексагидроксиантрахиноном (руфигаллолом), количественно - гравиметрич. методом в виде НfO2 или колориметрически по р-ции с пирокатехиновым фиолетовым, ализарином, арсеназо и др. Осаждают Г. в виде гидроксидов, фосфата, арсената, комплексов с купфероном и др. Для определения Г. в присут. Zr используют физ. методы-атомно-абсорбционный, активационный, рентгенорадиометрич., реже-методы изотопного разбавления, спектральные и масс-спектрометрический. Активац. анализ основан на измерении активности радиоактивных изотопов, образующихся в результате ядерной р-ции при облучении смеси ZrO2 и НfO2 нейтронами. Поскольку сечение захвата тепловых нейтронов Г. значительно выше, чем Zr, выбирают такое время облучения, когда активируется практически только Г. Рентгенорадиометрич. анализ основан на возбуждении атомов Zr и Hf с помощью первичного излучения радиоактивного изотопа и на послед. регистрации характеристич. (вторичного) излучения возбужденных атомов Zr и Hf.
Применение. Осн. часть производимого Г. используется в ядерных реакторах для изготовления регулирующих стержней и защитных экранов. Г. применяется также в кач-ве материала для катодных трубок и электродов в выпрямителях и газоразрядных трубках высокого давления, фольга из Г.-для изготовления фотографии, ламп-вспышек. Из жаропрочных сплавов на основе Та, W и Мо с добавкой Г. в ракетной и космич. технике изготовляют камеры сгорания реактивных двигателей, каркас и обшивку космич. ракет. Сплавы Nb с Hf (10 или 49%) используют для изготовления ответственных деталей реактивных самолетов.
Порошкообразный
и губчатый Г. пирофорны. Порошок Г. воспламеняется на воздухе от трения
и ударов, горит с большой скоростью, развивая высокую т-ру; смесь с воздухом
взрывоопасна; порошок с размером частиц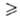 10 мкм может самовоспламеняться на воздухе. Влажные порошки горят со взрывом,
наиб. опасна влажность 5-10%. В сильно увлажненном состоянии (не менее
15-20% Н2О) порошки Hf могут храниться не воспламеняясь.
10 мкм может самовоспламеняться на воздухе. Влажные порошки горят со взрывом,
наиб. опасна влажность 5-10%. В сильно увлажненном состоянии (не менее
15-20% Н2О) порошки Hf могут храниться не воспламеняясь.
Мировое произ-во Г. (без СССР) 35-40 т/год. Г. открыт Д. Хевеши и Д. Костером в 1923.
Лит.:
Шека И. А., Карлышева К. Ф., Химия гафния, К., 1972; Металлурга я циркония
и гафния, под ред. Л.Г. Нехамкина, М., 1979; Чекмарев А. М., "Координационная
химия", 1981, т. 7, в. 6, с. 819-52; Clark R. J. H., Bradley D. С., Thorn
ton P., The chemistry of titanium, zirconium and hafnium, Oxf.-[a.o.],
1975. Г.А.Ягодин, A.M. Чекмарев.


