ВАНАДАТЫ, соли ванадиевых к-т. Различают : В.(V) - соли не существующих в своб. состоянии или малоустойчивых к-т -ортованадиевой H3VO4, пированадиевой H4V2O7, метаванадиевой HVO3, декаванадиевой H6V10O28, додекаванадиевой H2V12O31 и др. по ли ванадиевых к-т; В.(IV)-соли не существующих в своб. состоянии к-т - Н2V4О9, H4V2O6 и др. [устаревшие назв. В.(IV) - ванадиты, гипованадаты]. Существуют также гидроксованадаты, гидрованадаты и В. с анионами др. к-т, напр. соед. со структурой апатита Ca5(VO4)3CO3. Известны двойные и тройные В., в частности ортованадаты со структурой гранатов, напр. Na3Cr2V3012, LiCa2Mg2V3012.
В состав анионов B.(V) входят изолированные или связанные ванадийкислородные группировки. Структура метаванадатов щелочных металлов цепочечная, построена из тетраэдпов VО4, связанных общими вершинами. Пированадаты М4V2О7 построены из группировок V2О7 (два сочлененных вершинами тетраэдра VО4). Декаванадаты состоят из плотноупакованных октаэдров VO6.
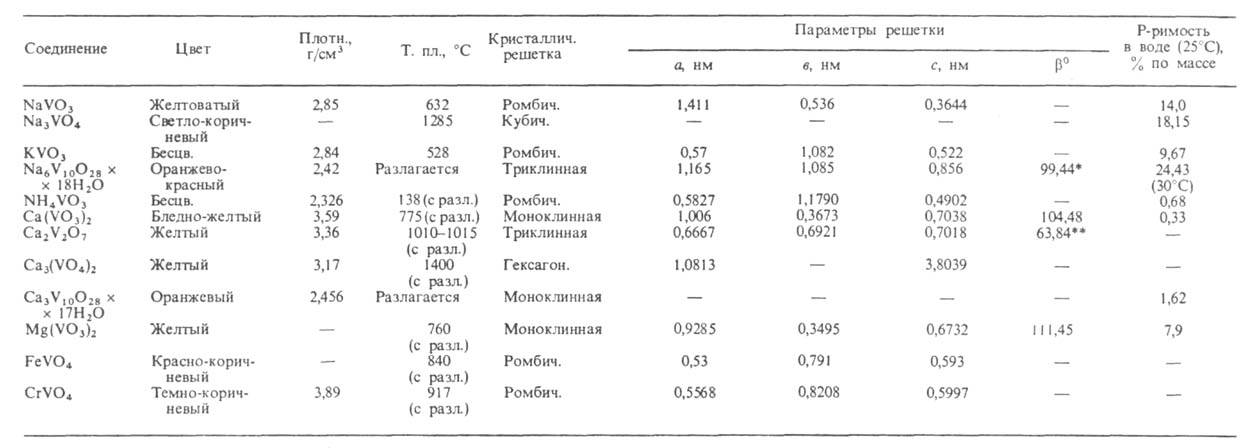
Св-ва важнейших B.(V) представлены в таблице. Т-ры плавления безводных В. повышаются при переходе от мета- к пиро- и ортованадатам. наиб. р-римостью в воде обладают В. щелочных металлов. Соли Са и тяжелых металлов обычно малорастворимы. Р-римость В. уменьшается от дека- к ортованадатам. Очень многие В. раств. инконгруэнтно. В водных р-рах в зависимости от рН и концентрации ванадатов м. б. устойчивы разл. ванадатионы (см. рис.). В соответствии с этим из водных р-ров осаждаются В. разл. состава, обычно гидратированные. Полное обезвоживание кристаллогидратов дека- и др. поливанадатов сопровождается их разложением до оксидов металлов и соед. типа ванадиевых бронз (см. Бронзы оксидные). При добавлении Н2О2 к р-рам В. щелочных металлов в щелочных и слабокислых средах образуются моно- и дипероксованадат-ионы - [VO3(O2)]3 ~ и [VO2(O2)2]3-, окрашивающие р-р в желтый цвет, в сильнокислых средах -ионы [V(O2)]3+ , вызывающие коричнево-красное окрашивание. B.(V) окрашивают многие орг. соед. - резорцин, стрихнин, фенол, анилин и др.
СВОЙСТВА ВАНАДАТОВ(V)
*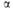 =
101,23°,
=
101,23°,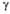 =
105,48°. **
=
105,48°. **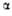 =
86,38°,
=
86,38°, =
83,64°.
=
83,64°.
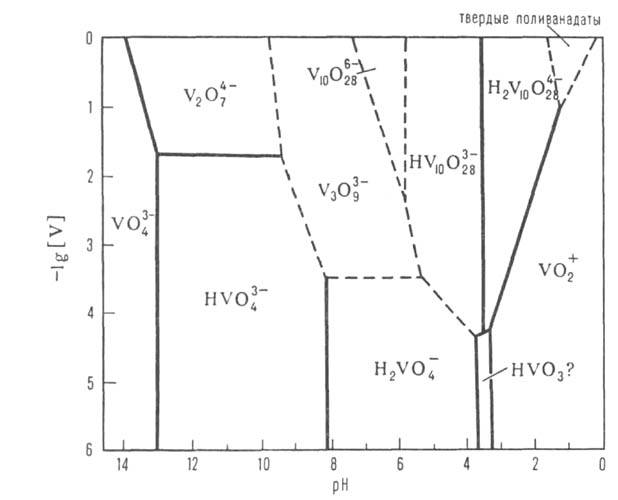
Диаграмма состояния ванадатов(V) в водном р-ре. [V]-концентрация иона V5+ . Пунктирными линиями обозначены приблизительные границы областей существования ванадат-ионов.
B.(V) встречаются в природе. Известны, напр., минералы пинтадоит Ca2V2O7*9H2O, россит Ca(VO3)2*4Н2О, паскоит Ca3V10O28*17H2O.
Безводные B.(V), в т.ч. пиро- и ортованадаты мн. металлов, получают спеканием их оксидов, карбонатов или нитратов с V2O5 или NH4VO3 в атмосфере кислорода. В. тяжелых металлов, а также А1 и нек-рых др. осаждают из р-ров В. щелочных металлов или аммония при добавлении р-римой в воде соли металла. Метаванадаты щел.-зем. металлов, Мп и др. образуются при кипячении суспензии гидроксидов, галогенидов или карбонатов металлов с V2O5.
В пром-сти при переработке ванадиевого сырья обычно в кач-ве промежут. или конечных продуктов получают нормальные В., гидрованадаты, двойные декаванадаты (или др. поливанадаты) Na, аммония, Са, Fe, A1 с разл. кол-вом кристаллизационной воды. Их применяют для получения V2O5 и других соед. V, для выплавки феррованадия и др. сплавов ванадия. B.(V) используют также как протраву при крашении тканей, для фиксации анилина на шелке, как катализаторы (напр., ванадаты Сг и Fe - компоненты катализатора окисления спиртов в альдегиды, КVO3- компонент катализатора окисления SO2 до SO3); они входят в состав стекол и глазурей. Ванадаты Са - лазерные материалы, Са3(VО4)2 - сегнетоэлектрик. Ортованадаты РЗЭ (La, Nd, Gd, Tb, Но) - кристаллофосфоры, активаторы в люминесцирующих стеклах, лазерные материалы; твердые р-ры ортованадатов Y и Ей-красные люминофоры в цветных телевизорах. Метаванадат NH4VO3 - реагент в ванадатометрии, компонент чернил, реагент для обнаружения алкалоидов с бензоильной группой. Прир. В. - сырье для получения Рb и V [ванадинит Pb5(VO4)3Cl], а также U [карнотит K2(UO2)2(VO4)2*3H2O, тюямунит Ca(UO2)2(VO4)2*8Н2О].
B.(IV) известны для щелочных, щел.-зем. и многих тяжелых металлов, аммония. Это окрашенные кристаллич. в-ва состава M2V4O9*nН2О, MIIV4O9*nH2O, M4V2O6, М2IIV2O6, MIH3V2O6 и др. В. токсичны; ПДК 0,5 мг/м в пересчете на V2O5.
Лит.: Фотиев А. А., Трунов В. К., Журавлев В. Д., Ванадаты двухвалентных
металлов, М., 1985; см. также лит. при ст. Ванадий. Н.П. Слотвинскш-Сидак.


