БОРОВОДОРОДЫ (бораны, гидриды бора), соед. общей ф-лы ВnНm, где п находится в пределах от 2 до 20, а m обычно равно п + 4 или п + 6. Св-ва нек-рых Б. представлены в таблице; др. известные Б. - октабораны В8Н12, В8Н14, В8Н16 и В8Н18, нонаборан В9Н15, гексадекаборан В16Н20, октадекаборан В18Н22, эйкозабораны В20Н16 и В20Н26.
Для молекул Б. (см. рис.) характерен дефицит электронов, высокие координац. числа атома В (до 7), наличие мостиковых связей В—Н—В, существование кластерных группировок из соединенных друг с другом атомов В. Атомы бора в молекулах объединены в полиэдрич. группировки-фрагменты икосаэдра (В12) или октаэдра (В6). Длины связей В—В 0,169-0,187 нм, В—Н в концевых группах 0,119-0,120 нм, во фрагментах В—Н—В 0,133-0,143 нм.
В соед. В2Н6 концевые группы ВН2 лежат в одной плоскости, атомы В и Н в них образуют двухэлектронные двухцентровые связи. Два центральных атома Н объединены с атомами В трехцентровыми двухэлектронными связями В—Н—В, образующимися в результате перекрывания sр3-гибридных орбиталей двух атомов В и s-орбитали атома Н. Эффективный заряд на мостиковых атомах Н — 0,22, на атомах В + 0,22. В молекуле В4Н10 шесть двухцен-тровых связей В—Н, четыре трехцентровые В—Н—В и одна двухцентровая В—В. Молекулы В5Н9 и В10Н14, помимо связей описанных типов, содержат трехцентровые связи В—В—В.
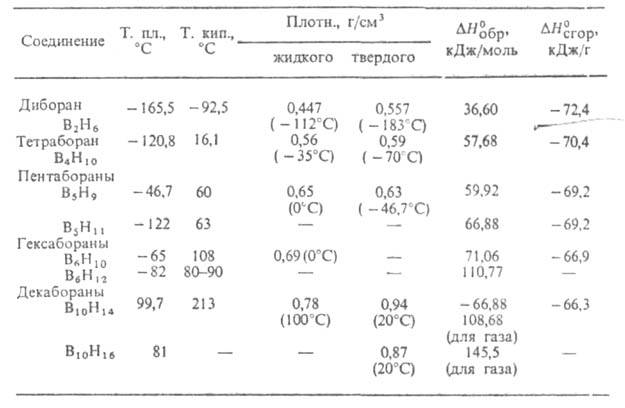
Б. бесцветны, обладают резким неприятным запахом. Соед. В2Н6
и В4Н10 - газы, Б. с п = 5-9-жидкости, с п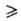 10 - кристаллы. Все Б. хорошо раств. в орг. р-рителях. Б. химически весьма
активны (особенно члены ряда ВnНn+6). На воздухе
окисляются до В2О3, а при п = 2-6 самовоспламеняются.
С водой образуют Н3ВО3 и Н2, со спиртами
- алкилбораты и Н2. Вступают в электроф. и нуклеоф. замещение,
напр.: В10Н14 + 2(CH3)2S ->
B10H12[S(CH3)2]2 +
Н2. С ненасыщенными углеводородами образуют борорг. соед. (гидроборирование),
напр.: В2Н6 + 6С2Н4 -> 2В(С2Н5)3.
С гидридами металлов дают комплексные гидриды, напр.: В2Н6
+ 2NaH -> 2Na[BH4]. Характерная р-ция Б.-расщепление
связи В—Н—В: 2В4Н10 + 2R2O -> 2В3Н7*OR2
+ В2Н6. Б. весьма склонны к образованию соед., содержащих
комплексные анионы [ВН4]-, [В3Н8]-,
[В9Н14]-, [В10Н13]-,
[В10Н14]2-, [В20Н20]4-
и др., напр.: В2Н6 + Na[BH4] -> Na[B3H8]
+ Н2. Особенно устойчивы химически и термически соед. с анионами
[ВnНn]2-, где n = 6-12. Пиролиз Б., как
правило, сопровождается полимеризацией и конденсацией образующихся низших
гидридов; при этом связи В—В не разрываются.
10 - кристаллы. Все Б. хорошо раств. в орг. р-рителях. Б. химически весьма
активны (особенно члены ряда ВnНn+6). На воздухе
окисляются до В2О3, а при п = 2-6 самовоспламеняются.
С водой образуют Н3ВО3 и Н2, со спиртами
- алкилбораты и Н2. Вступают в электроф. и нуклеоф. замещение,
напр.: В10Н14 + 2(CH3)2S ->
B10H12[S(CH3)2]2 +
Н2. С ненасыщенными углеводородами образуют борорг. соед. (гидроборирование),
напр.: В2Н6 + 6С2Н4 -> 2В(С2Н5)3.
С гидридами металлов дают комплексные гидриды, напр.: В2Н6
+ 2NaH -> 2Na[BH4]. Характерная р-ция Б.-расщепление
связи В—Н—В: 2В4Н10 + 2R2O -> 2В3Н7*OR2
+ В2Н6. Б. весьма склонны к образованию соед., содержащих
комплексные анионы [ВН4]-, [В3Н8]-,
[В9Н14]-, [В10Н13]-,
[В10Н14]2-, [В20Н20]4-
и др., напр.: В2Н6 + Na[BH4] -> Na[B3H8]
+ Н2. Особенно устойчивы химически и термически соед. с анионами
[ВnНn]2-, где n = 6-12. Пиролиз Б., как
правило, сопровождается полимеризацией и конденсацией образующихся низших
гидридов; при этом связи В—В не разрываются.
Наиб. практич. значение имеет диборан В2Н6, к-рый
применяют для получения высокочистого В, легирования бором разл. материалов,
синтеза борорг. соединений. Получают его по р-циям:
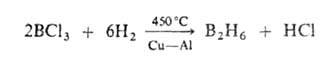
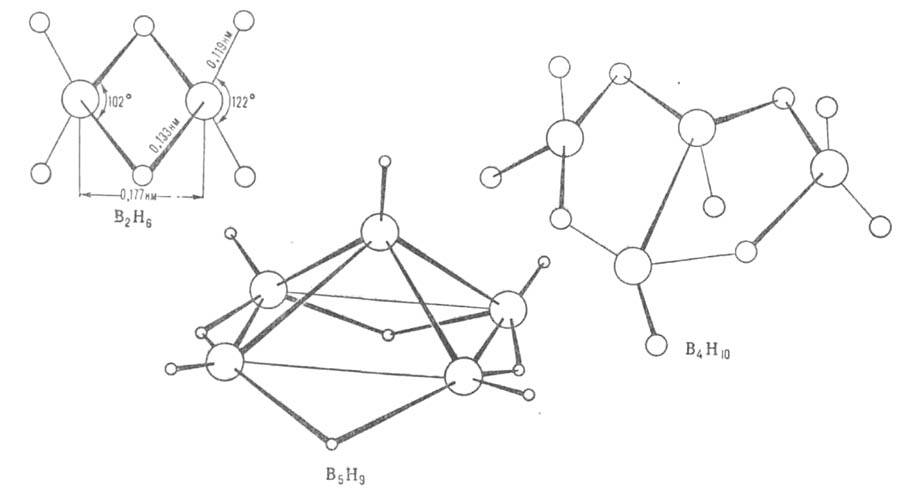
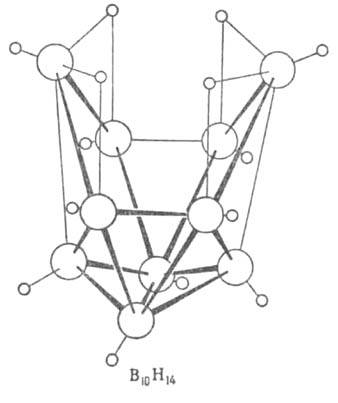
Структура молекул бороводородов; большими кружками обозначены атомы
В. меньшими - атомы Н.
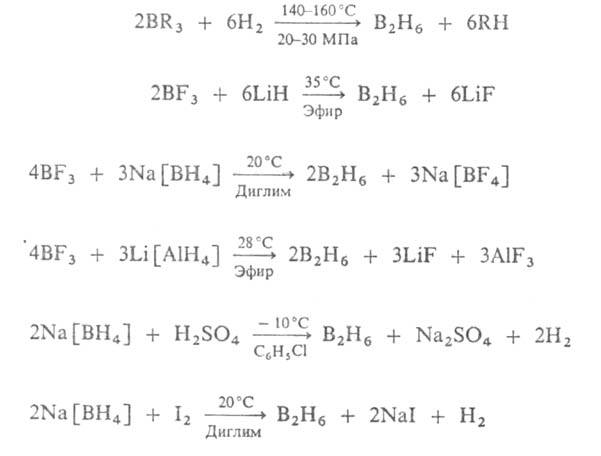
Осн. метод получения других Б. - конверсия В2Н6
по р-циям, к-рые м.б. представлены след. схемой:
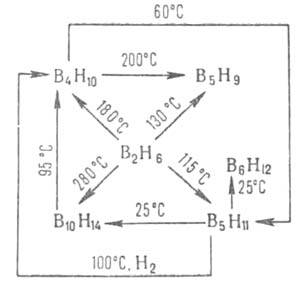
Б. с п > 2 используют для получения карборанов.
Для анализа Б. их разлагают водой, водно-спиртовыми смесями, действием Н2О2 или др. окислителей, затем определяют В и объем выделившегося Н2. Индивидуальные Б. в их смесях определяют методами низкотемпературного фракционирования, хроматографии, ЯМР и ИК-спектроскопии.
Энтальпия сгорания Б. значительно превышает энтальпию сгорания мн. орг. соединений, поэтому Б. представляют большой интерес как перспективное высокоэффективное ракетное горючее. Однако широкое их применение в ракетной технике сдерживается сложностью произ-ва
Соед. В6Н10 образуется при разложении В5Н11 в вакууме при — 20 °С в среде диглима, В8Н12 - при взаимод. В2Н6 и В5Н9 в вакууме, В9Н15 - при каталитич. конверсии В5Н11 при 0°С в присут. гексаметилентетрамина, В20Н16 и В20Н26 - при пиролизе декаборанов соотв. при 350 и 100°С, В16Н20 и В18Н22 - при разложении (100°С) соотв. (CH3)2SB9H13 и (С2Н5)2ОВ9Н13. и чрезвычайной токсичностью (до 1981 проведены в СССР и США только стендовые испытания экспериментальных жидкостных ракетных двигателей на ди- и пентаборанах). Так, В2Н6 обладает, подобно фосгену, удушающим действием, В5Н9, В5Н11, В10Н14 и В10Н16 поражают центр. нервную систему, почки и печень. В США ПДК для В2Н6
СВОЙСТВА БОРОВОДОРОДОВ
0,1, для В5Н9 и В5Н11-0,01, для В10Н1б-0,3 мг/м3.
Лит.: Михайлов Б. М., Химия бороводородов, М., 1967; Жигач А.
Ф., Стасиневич Д. С, Химия гидридов, Л., 1969; Kirk-Othmer encyclopedia,
3 ed., v. 4, N.Y.-[a.o.J, 1978, p. 151. Н.Т.Кузнецов.


