1. Разработка методов выделения и очистки прир. соединений; характерная особенность Б. х. - использование при этом специфич. биол. ф-ций изучаемого в-ва для контроля стадий очистки (напр., контроль чистоты антибиотика ведется по его антимикробной активности, гормона - по его влиянию на определенный физиол. процесс и т.д.).
2. Определение строения и конфигурации изучаемого соед., для чего используют разл. методы, в первую очередь химические: гидролиз, окислит. расщепление, расщепление по специфич. фрагментам (напр., по остаткам метионина при установлении строения пептидно - белковых в-в, расщепление по 1,2-диольным группировкам углеводсодержащих в-в). Широко используются также физ. и физ.-хим. методы -ЯМР, масс-спектрометрия, ЭПР, рентгеноструктурный анализ, мёссбауэровская спектроскопия и др. На основе глубокого изучения механизма широко используемых при изучении строения р-ций и влияния условий на их течение созданы и находят широкое применение автоматич. устройства, обеспечивающие быстрое решение стандартных задач, особенно в аналит. химии пептидно-белковых в-в (анализаторы для определения количеств. аминокислотного состава, секвенаторы для выяснения последовательности аминокислотных остатков и др. - см. Белки). Важное значение при изучении строения сложных биополимеров имеет использование ферментов, особенно специфично расщепляющих изучаемое в-во по строго определенным связям. Такие ферменты имеют очень большое значение в изучении пептидно-белковых в-в (трипсин, протеиназы, расщепляющие связи по остаткам глутаминовой к-ты, пролина и др. аминокислотным остаткам), нуклеиновых к-т и полинуклеотидов (нуклеазы, рестриктазы), углеводсодержащих полимеров (гликозидазы, в т. ч. специфические - галактозидазы, глюкуронидазы и т.д.).
Для повышения эффективности применения хим. и физ.-хим. методов изучения структуры анализу подвергают не только прир. в-ва, но и их производные, содержащие характерные, специально вводимые группировки и меченые атомы, напр. путем выращивания продуцента на среде, содержащей меченые аминокислоты или др. радиоактивные предшественники, в состав к-рых входят тритий, радиоактивный углерод или фосфор. Достоверность данных, получаемых при изучении сложных белков, значительно повышается, если это изучение проводят в комплексе с исследованием строения соответствующих генов.
3. Разработка методов синтеза как самих прир. биологически важных в-в, так и ряда их аналогов. Для относительно просто построенных низкомол. соед. встречный синтез до сих пор является важным критерием правильности установленной структуры. Для биополимеров сравнение прир. в-ва с синтезированным образцом обычно не может служить надежным критерием правильности ранее определенной структуры. Однако, как и в случае низкомол. соед., синтез биополимеров и их аналогов необходим для решения след. важной задачи Б. х. - изучения зависимости биол. св-в от строения изучаемого в-ва.
4. Изучение зависимости биол. действия от строения. Этот аспект Б. х. приобретает все большее практич. значение. Весьма эффективные методы хим. и химико-энзиматич. синтеза сложных биополимеров (в-в белково-пептидной природы, сложных полинуклеотидов, включая активно функционирующие гены) наряду со все более совершенствующейся техникой синтеза относительно более простых биорегуляторов, а также методы избират. расщепления биополимеров позволяют все глубже понимать зависимость биол. действия от строения в-ва. Расширяющееся использование высокоэффективных ЭВМ дает возможность объективно сопоставлять многочисленные данные разных исследователей и находить общие закономерности. Найденные частные, а тем более общие закономерности, в свою очередь, стимулируют и облегчают синтез новых аналогов, что в ряде случаев (напр., при изучении пептидов, влияющих на деятельность мозга) позволяет находить практически важные синтетич. соед., превосходящие иногда по нек-рым св-вам прир. в-ва.
5. Выяснение химизма взаимодействия биологически активного в-ва с живой клеткой или с ее компонентами. Решение этой задачи открывает возможности создания оптимально активных соед. определенного типа действия. Первые успехи в этом направлении уже достигнуты. В частности, выяснен механизм действия соед., способных связывать и переносить в клетке ионы металлов (напр., калия), т. наз. ионофоров. К таким в-вам относятся валиномицин и его аналоги.
Б. х. сформировалась как самостоятельная область во 2-й пол. 20 в. на
стыке биохимии и орг. химии, на основе традиционной химии прир. соединений.
Ее развитие связано с именами Л. Прлинга (открытие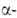 спирали
как одного из главных элеменов пространств. структуры полипептидной цепи
в белках), А. Тодда (выяснение хим. строения нуклеотидов и первый синтез
динуклеотида), Ф. Сенгера (разработка метода определения аминокислотной
последовательности в белках и расшифровка с его помощью структуры инсулина),
Дю Винь.о (хим. синтез биологически активного гормона окситоцина), Д. Бартона
и В. Прелога (конформационный анализ), Р. Вудворда (полный хим. синтез
мн. сложных прир. соединений, в т.ч. резерпина, хлорофилла, витамина В12)
и др. крупных ученых.
спирали
как одного из главных элеменов пространств. структуры полипептидной цепи
в белках), А. Тодда (выяснение хим. строения нуклеотидов и первый синтез
динуклеотида), Ф. Сенгера (разработка метода определения аминокислотной
последовательности в белках и расшифровка с его помощью структуры инсулина),
Дю Винь.о (хим. синтез биологически активного гормона окситоцина), Д. Бартона
и В. Прелога (конформационный анализ), Р. Вудворда (полный хим. синтез
мн. сложных прир. соединений, в т.ч. резерпина, хлорофилла, витамина В12)
и др. крупных ученых.
В нашей стране в становлении Б. х. огромную роль сыграли работы Н.Д. Зелинского, А. Н. Белозерского, И. Н. Назарова, Н.А. Преображенского и др. Инициатором исследований по Б. х. в СССР в нач. 60-х гг. явился М. М. Шемякин. Им, в частности, были начаты работы но изучению циклич. депсипептидов, к-рые впоследствии получили широкое развитие в связи с их ф-цией как ионофоров.
В конце 60-х - начале 70-х гг. при синтезе в-в сложной структуры начали применять в кач-ве катализаторов ферменты (т. наз. комбинированный химико-энзиматич. синтез). Этот подход был использован Г. Кораной для первого синтеза гена. Использование ферментов позволило осуществить строго избирательное превращение ряда прир. соед. и получить с высоким выходом новые биологически активные производные пептидов, олигосахаридов и нуклеиновых к-т.
Наиб. интенсивно в 70-х гг. развивались: синтез олигонуклеотидов и генов;
исследования клеточных мембран и полисахаридов; анализ первичной и пространств.
структур белков. В кач-ве примера можно указать на успешное изучение структуры
важных ферментов (трансаминаза,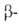 галактозидаза,
ДНК-зависимая РНК-полимераза), защитных белков (
галактозидаза,
ДНК-зависимая РНК-полимераза), защитных белков (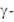 глобулины,
интерфероны), мембранных белков (аденозинтрифосфатазы, бактериородопсин).
Большое значение приобрели работы по изучению строения и механизма действия
пептидов - регуляторов нервной деятельности (т. наз. нейропептиды).
глобулины,
интерфероны), мембранных белков (аденозинтрифосфатазы, бактериородопсин).
Большое значение приобрели работы по изучению строения и механизма действия
пептидов - регуляторов нервной деятельности (т. наз. нейропептиды).
Б. х. тесно связана с практич. задачами медицины и с.х-ва (получение витаминов, гормонов, антибиотиков и других лек. ср-в, стимуляторов роста растений и регуляторов поведения животных и насекомых), хим., пищ. и микробиол. пром-сти. В результате сочетания методов Б. х. и генетической инженерии стало возможным практич. решение проблемы получения сложных биологически важных в-в белково-пептидной природы, включая такие высокомолекулярные, как инсулин человека, интерферон, гормон роста человека.
Лит.: Шемякин М.М., "Ж. Всес. хим. об-ва им. Д.И. Менделеева",
1971, т. 16, №2, с. 122-44; Овчинников Ю.А., вкн.: Октябрь и наука. [1917-1977],
М., 1977, с. 393-416; Дюга Г., Пенни К., Биоорганическая химия, пер. с
англ.. М.. 1983. Ю.А.Овчинников.


