БЕНЗОХИНОНЫ, мол. м. 108,10. Существуют в виде двух изомеров-1,2- и 1,4-Б. (ф-лы соотв. I и II).
1,2-Б. (3,5-циклогексадиен-1,2-дион; о-бензохинон; о-хинон) - ярко-красные
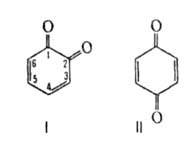
кристаллы; т. разл. 70-80°С, окислит.-восстановит. потенциал Е° — 0,795
В (Н20; 25 °С);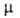 17,03*10-30 Кл*м (бензол; 20°С); раств. в воде, спирте, легко
- в эфире, гексане, хлороформе; в р-рах неустойчив.
17,03*10-30 Кл*м (бензол; 20°С); раств. в воде, спирте, легко
- в эфире, гексане, хлороформе; в р-рах неустойчив.
1,4-Б. (2,5-циклогексадиен-1,4-дион; n-бензохинон; хинон) - золотисто-желтые
кристаллы с резким запахом; т. пл. 116°С; d4201,320;
легко возгоняется; перегоняется с паром;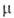 2,51*10-30 Кл*м (бензол; 20°С);
2,51*10-30 Кл*м (бензол; 20°С);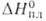 20,95 кДж/моль;
20,95 кДж/моль;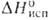 47,76 кДж/моль (115-128°С); So298 - 187,5
кДж/моль; окислит.-восстановительный потенциал Е° — 0,711 В (бензол;
25°С);
47,76 кДж/моль (115-128°С); So298 - 187,5
кДж/моль; окислит.-восстановительный потенциал Е° — 0,711 В (бензол;
25°С);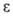 3,12 (17°С); легко растворим в спирте, эфире, горячем лигррине; растворимость
в воде 0,7% (5°С1 1,5% (30 °С).
3,12 (17°С); легко растворим в спирте, эфире, горячем лигррине; растворимость
в воде 0,7% (5°С1 1,5% (30 °С).
Б. легко и обратимо восстанавливаются Н2 (кат.-РЮ2),
SO2, гидразином, напр.:
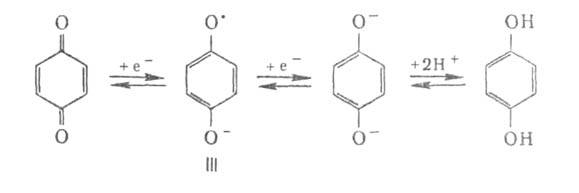
Благодаря способности превращаться в устойчивые анионрадикалы - семихиноны
(III) Б. образуют с донорами электронов прочные комплексы с переносом заряда,
напр. 1,4-Б. - с бензолом, толуолом, нафталином, антраценом в соотношении
1:1, с фенолом - 1:1 и 1:2 (фенохинон), гидрохиноном - 1:1 (хингидрон).
Последний - темно-фиолетовые кристаллы с металлич. блеском; т. пл. 171
°С;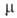 6,68*10-30
Кл*м (диоксан; 20°С);
6,68*10-30
Кл*м (диоксан; 20°С);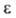 4,12
(17°С); окислит.-восстановит. потенциал Е° 0,699 В (вода; 25°С);
р-римость в воде 0,35% (20 °С), 1,035% (50 °С); распадается на компоненты
в растворе уксусной кислоты. Действием порошка Zn в уксусном ангидриде
Б. превращ. в диацетоксибензолы.
4,12
(17°С); окислит.-восстановит. потенциал Е° 0,699 В (вода; 25°С);
р-римость в воде 0,35% (20 °С), 1,035% (50 °С); распадается на компоненты
в растворе уксусной кислоты. Действием порошка Zn в уксусном ангидриде
Б. превращ. в диацетоксибензолы.
1,4-Б. с первичными аминами образует замещенные монохинонимины (IV),
с гидроксиламином-n-хинонмонооксим (таутомерен с n-нитрозофенолом) и n-хинондиоксим
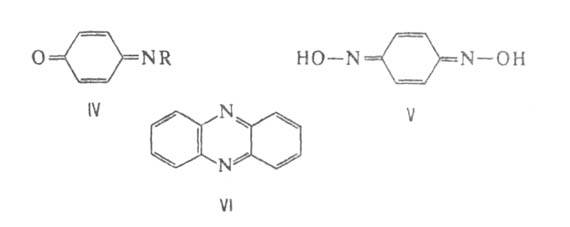
(V). 1,2-Б. с о-фенилендиамином дает феназин (VI).
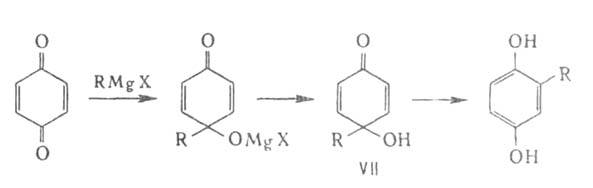
При взаимод. с реактивом Гриньяра Б. превращ. в хинолы (VII), перегруппировывающиеся
в алкилгидрохиноны, напр.:
Б., подобно ненасыщенным
кетонам, способны к 1,2-присоединению по связи С—С и 1,4-присоединению
по связям С=С и С=О. Продукты 1,4-присоединения окисляются избытком исходного
Б., если их окислит.-восстановит. потенциал ниже, чем у Б. Так, с метанолом
1,4-Б. образует 2,5-диметокси-1,4-бензохинон (кат.-ZnС12), с
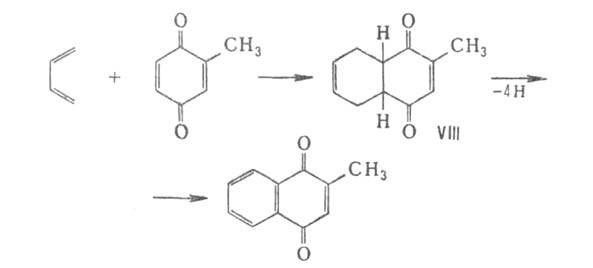
анилином - 2,5-дианилино-1,4-бензохинон. В р-ции Дильса - Альдера 1,2-Б.
выступает как диен и диенофил, 1,4-Б. - как диенофил. Так, 1,4-толухинон
с 1,3-бутадиеном в бензоле на холоду образует 2-метил-5,8,9,10-тетрагидронафтохинон
(VIII), к-рый дегидрируется при 120°С в 2-метил-1,4-нафтохинон (витамин
К3):
ненасыщенным
кетонам, способны к 1,2-присоединению по связи С—С и 1,4-присоединению
по связям С=С и С=О. Продукты 1,4-присоединения окисляются избытком исходного
Б., если их окислит.-восстановит. потенциал ниже, чем у Б. Так, с метанолом
1,4-Б. образует 2,5-диметокси-1,4-бензохинон (кат.-ZnС12), с
анилином - 2,5-дианилино-1,4-бензохинон. В р-ции Дильса - Альдера 1,2-Б.
выступает как диен и диенофил, 1,4-Б. - как диенофил. Так, 1,4-толухинон
с 1,3-бутадиеном в бензоле на холоду образует 2-метил-5,8,9,10-тетрагидронафтохинон
(VIII), к-рый дегидрируется при 120°С в 2-метил-1,4-нафтохинон (витамин
К3):
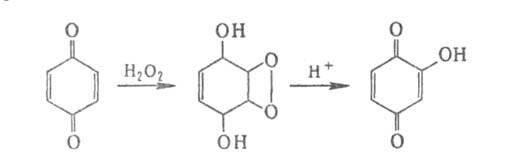
С Н2О2 в щелочной среде Б. образует эпоксигидрохинон,
превращающийся в кислой среде в гидроксихинон, напр.:
Атомы Н ядра Б. способны замещаться, напр. с фенилдиазонийхлоридом 1,4-Б. образует 2-фенил-1,4-бензохинон, 1,2-Б.-4-фенил-1,2-бензохинон (р-ция Меервейна).
1,2-Б. действием О2 (кат. - комплекс СиС12-пиридин)
в среде метанола расщепляется с образованием моно- и диметилмуконатов:
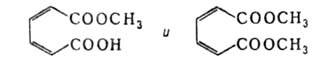
1,4-Б. устойчив к действию окислителей.
Гидроксибензохинон существует в двух таутомерных формах:
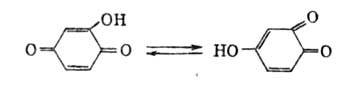
Они этерифицируются при нагр. в спирте в присут. кислых катализаторов. Галоген- и алкоксибензохиноны легко омыляются щелочными агентами до гидроксибензохинонов. Атом галогена в галогенбензохинонах легко замещается на амино- и алкоксигруппы.
Замещенные 1,4-Б. - окислители, обратимо восстанавливающиеся в гидрохиноны. Они участвуют в переносе электронов в процессах клеточного дыхания. В пром-сти 1,4-Б. получают окислением анилина действием МnО2 (пиролюзит) в H2SO4 при 3-10 °С или Na2Cr2O7 в H2SO4 при 20°С. Аналогично из замещенных анилинов получают замещенные 1,4-Б., напр. толухинон, n-ксилохинон, 2,6-диметил-1,4-бензохинон. 1,2-Б. и его алкилпроизводные получают из соответствующих пирокатехинов окислением Ag2O в сухом эфире в присут. Na2SO4 при 20°С или РbO2 в бензоле в присут. Na2SO4 (выход 70%). 1,4-Б. - промежут. продукт в произ-ве гидрохинона. Его применяют в произ-ве красителей, как дубящее в-во. Он вызывает превращ. гемоглобина в метгемоглобин, что приводит к анемии; раздражает кожу; ПДК 0,05 мг/м3. 1,4-Б. впервые получен А. А. Воскресенским в 1838 окислением хинной (тетрагидроксибензойной) к-ты МnО2 в H2S04.
Лит.: Кэсон Д., в сб.: Органические реакции, пер. с англ., сб.
4, М., 1951, с. 270-336; MortonR.A.. Biochemistry, of quinones,
L. N.Y., 1965; Ullmanns Encyklopadie, Bd 8, Weinheim-N.Y., 1977, S. 364.
Н.Б.Карпова.


