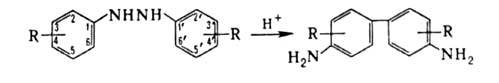
Обычно осуществляется под действием сильных к-т. Осн. побочные продукты-2,2'- и 2,4'-диаминодифенилы, а также 2- и 4-аминодифениламины. Направление и скорость Б. п. существенно зависят от характера и положения заместителей. Нек-рые из них могут при Б. п. отщепляться; легкость отщепления уменьшается в ряду: SO3H, СО2Н > RC(O), Cl > OR; заместители RC(O)NR, NR2 и Alk не отщепляются.
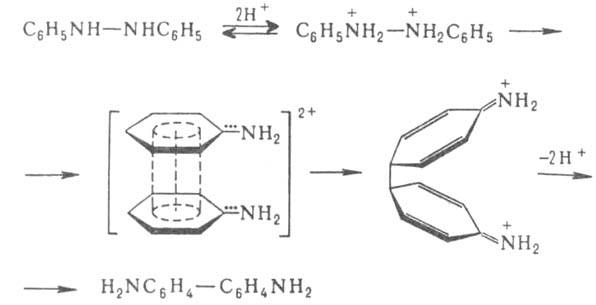
Б. п. - внутримолекулярная р-ция. Механизм перегруппировки гидразобензола
включает присоединение на первой стадии р-ции двух протонов. Предполагают,
что затем происходит гомолиз связи N—N, приводящий к образованию двух катион-радикалов,
связь между к-рыми осуществляется перекрыванием р-орбиталей ароматич. колец;
образование связи между атомами углерода в пара - положениях бензольных
колец с послед. отрывом от них двух протонов приводит к бензидину:
Если исходные арилгидразины содержат в молекуле два трудноотщепляемых
заместителя в пара-положениях, происходит т. наз. полубензидиновая, или
семидиновая, перегруппировка, приводящая к 2-аминодифениламину (осемидину):
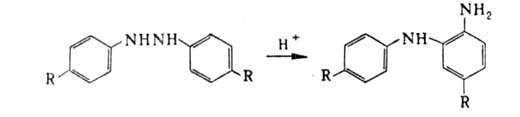
Если в арилгидразине занято только одно из пара-положений, то в зависимости от природы заместителя осн. продуктом будет 2,4'-диаминодифенил или о-семидин.
Б. п. может осуществляться и без к-ты в р-рителях при 80-130°С (термин. Б. п.), однако селективность такой р-ции значительно ниже. С увеличением полярности р-рителя скорость термич. Б. п. возрастает. Б. п. используется в произ-ве азокрасителей и диаминов, напр. бензидина, толидина, дианизидина. Открыта Н.Н. Зининым в 1845 на примере перегруппировки 1,2-дифенилгидразина.
Лит.. Ингольд К., Теоретические основы органической химии, пер.
с англ., М.. 1973, с. 756-79; Обшая органическая химия, пер. с англ., т.
3, М., 1982, с. 281-82. М.П. Егоров.


