К мембранным Б.-п. относятся белки систем трансмембранного переноса Сахаров, аминокислот и др. метаболитов. Эти белки интегрированы в составе биол. мембран. Во мн. случаях мембранные Б.-п. образуют системы транспорта, в к-рых отдельные ф-ции разделены между разными белками. Так, у бактерий в систему транспорта аминокислот и нек-рых углеводов входят по крайней мере по два белка - один, выполняющий ф-ции рецепции субстрата (связывающий белок), другой - осуществляющий собственно перенос (транслокацию) в-ва через мембрану. Для нек-рых организмов, особенно для бактерий, характерно присутствие неск. систем транспорта одного и того же в-ва. Так, транспорт глюкозы у Escherichia coli осуществляется не менее чем пятью разными системами.
Несколько особняком стоят липидпереносящие белки, к-рые обнаружены как в мембранных структурах, так и в плазме крови. Они переносят лишь определенный тип фосфолипидов и участвуют в построении биол. мембран.
К Б.-п. можно отнести также нек-рые ферменты и ферментные системы. Так,
у бактерий моносахариды переносятся фосфоэнолпируват-зависимой системой,
включающей низкомол. белок - переносчик фосфатной группы с фосфоэнолпирувата
на сахар и два фермента, один из к-рых, повидимому, выполняет ф-ции транслокации
фосфорилированного сахара. Другой фермент (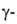 глутамилтрансфераза)участвует в транспорте аминокислот в клетках животных. Предполагается,
что нек-рые пептиды вовлечены в транспорт аминокислот через мембрану энтероцитов
(клетки эпителия кишечника). Хорошо изучена роль Na-K-зависимой аденозинтрифосфатазы
в переносе протонов и Са-зависимой аденозинтрифосфатазы в транспорте
Са2+. Важную роль играют Б.-п., образующие ионные каналы в нервных
волокнах.
глутамилтрансфераза)участвует в транспорте аминокислот в клетках животных. Предполагается,
что нек-рые пептиды вовлечены в транспорт аминокислот через мембрану энтероцитов
(клетки эпителия кишечника). Хорошо изучена роль Na-K-зависимой аденозинтрифосфатазы
в переносе протонов и Са-зависимой аденозинтрифосфатазы в транспорте
Са2+. Важную роль играют Б.-п., образующие ионные каналы в нервных
волокнах.
Большинство Б.-п. плазмы крови и нек-рые мембранные- гликопротеины. Для нек-рых Б.-п. известна первичная структура, а для неск. представителей (гемоглобин, преальбумин, арабинозосвязывающий белок) - пространственная. Доказательство участия Б.-п. в транспорте у бактерий и дрожжей основаны гл. обр. на изучении дефектных по транспорту мутантов. Кинетика транспорта с участием Б.-п. характеризуется явлением насыщения. Константы комплексообразования Б.-п. - субстрат обычно лежат в области 106 М-1, для периплазматич. связывающих белков достигают 108 М-1. Механизм комплексообразования известен для ограниченного числа Б.-п. наиб. полно изучено связывание О2 гемоглобином. Полифункциональные Б.-п. имеют неск. центров связывания для разл. транспортируемых в-в. Напр., в альбумине участки связывания жирных к-т, глутатиона, билирубина и нек-рых ионов расположены на разных субдоменах. Связывание арабинозы арабинозосвязывающим белком происходит на границе двух доменов.
СВОЙСТВА БЕЛКОВ-ПЕРЕНОСЧИКОВ

Недостаточное содержание нек-рых Б.-п. в организме -причина ряда заболеваний. Известны многочисленные генетически обусловленные заболевания, связанные с изменением структуры гемоглобина (напр., серповидная анемия). Понижение уровня церулоплазмина при болезни Вильсона приводит к накоплению Си в мозге и печени и нарушению работы этих органов.
Лит.: Никольский Н. Н., Трошнн А. С, Транспорт Сахаров через
клеточные мембраны. Л., 1973; Антонов В. К., Александров С. Л., "Биоорганическая
химия", 1977, т. 3, №5, с. 581-99; КотыкА., Яначек К., Мембранный транспорт,
пер. с англ., М., 1980. В.К.Антонов.


