По составу Б. делят на простые, состоящие только из аминокислотных остатков, и сложные. Сложные могут включать ионы металла (металлопротеиды) или пигмент (хромопротеиды), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми к-тами (нуклеопротеиды), а также ковалентно связывать остаток фосфорной к-ты (фосфопротеиды), углевода (гликопротеины)или нуклеиновой к-ты (геномы нек-рых вирусов). В соответствии с формой молекул Б. подразделяют на глобулярные и фибриллярные. Молекулы первых свернуты в компактные глобулы сферич. или эллипсоидной формы, молекулы вторых образуют длинные волокна (фибриллы) и высокоасимметричны. Большинство глобулярных Б., в отличие от фибриллярных, растворимы в воде. Особую группу составляют мембранные (амфипатические) Б., характеризующиеся неравномерным распределением гидрофильных и гидрофобных (липофильных) участков в молекуле: погруженная в биол. мембрану часть глобулы состоит преим. из липофильных аминокислотных остатков, а выступающая из мембраны - из гидрофильных.
Историческая справка. Первые работы по выделению и изучению белковых препаратов были выполнены еще в 18 в., однако в тот период исследования Б. носили описательный характер. В нач. 19 в. были сделаны первые анализы элементного состава Б. (Ж. Л. Гей-Люссак, Л. Ж. Тенар, 1810), положившие начало систематич. аналит. исследованиям, в результате к-рых было установлено, что все белковые в-ва близки не только по внеш. признакам и св-вам, но и по элементному составу. Важное следствие этих работ - создание первой теории строения белковых в-в (Г.Я. Мульдер, 1836), согласно к-рой все Б. содержат общий гипотетич. радикал - "протеин", имеющий эмпирич. ф-лу C40H62N10O12 и связанный в разл. пропорциях с атомами серы и фосфора. Получив вначале всеобщее признание, эта теория привлекла интерес к аналит. исследованиям Б., совершенствованию препаративных методов белковой химии. В этот период были разработаны простейшие приемы выделения Б. путем экстракции р-рами нейтральных солей и осаждения, получены первые кристаллич. Б. (гемоглобин, нек-рые растит. Б.), для анализа Б. стали использовать кислотный и щелочной гидролиз.
Создание теории протеина совпало по времени с формированием представлений о функции Б. в организме. В 1835 Й.Я. Бёрцедиус высказал идею о важнейшей ф-ции Б.- биокаталитической. Вскоре были открыты первые протеолитич. ферменты - пепсин (Т. Шмнн._1836) и трипсин (Л. Корвизар, 1856). Открытие протеаз стимулировало интерес биохимиков к физиологии пищеварения, а следовательно, и к продуктам переваривания Б. К сер. 19 в. было показано, что под действием протеолитич. ферментов Б. распадаются на близкие по св-вам фрагменты, получившие назв. пептонов (К. Леман, 1850).
Важное событие в изучении Б. - выделение из белкового гидролизата аминокислоты глицина (А. Браконно, 1820). К кон. 19 в. было изучено большинство аминокислот, входящих в состав Б., синтезирован аланин (А. Штреккер, 1850). В 1894 А. Косеелъ высказал идею о том, что осн. структурными элементами Б. являются аминокислоты.
В нач. 20 в. значит. вклад в изучение Б. был внесен Э. Фишером, .впервые
применившим для этого методы орг. химии. Путем встречного синтеза Э. Фишер
доказал, что Б. построены из остатков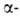 аминокислот,
связанных амидной (пептидной) связью. Он также выполнил первые аминокислотные
анализы Б., дал правильное объяснение протеолизу.
аминокислот,
связанных амидной (пептидной) связью. Он также выполнил первые аминокислотные
анализы Б., дал правильное объяснение протеолизу.
В 20-40-е гг. получили развитие физ.-хим. методы анализа Б. Седиментационными
и диффузионными методами были определены мол. массы многих Б., получены
данные о сферич. форме молекул глобулярных Б. (Т. Сведберг, 1926), выполнены
первые рентгеноструктурные анализы аминокислот и пептидов (Дж. Д. Бернал,
1931), разработаны хроматографич. методы анализа (А. Мартин, Р. Синг, 1944).
Существенно расширились представления о функциональной роли Б.: был выделен
первый белковый гормон - инсулин (Ф. Бантинг, Ч. Г. Бест, 1922), антитела
были идентифицированы как фракция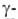 глобулинов
(1939) и тем самым обнаружена новая ф-ция Б. - защитная. Важным этапом
явилось открытие ферментативной ф-ции мышечного миозина (В. А. Энгельгардт,
М.Н.Любимова, 1939) и получение первых кристаллич. ферментов (уреазы-Дж.Б.
Салшер, 1926; пепсина - Дж.X. Нортроп, 1929; лизоцима - Э. П. Абрахам,
Р. Робинсон, 1937).
глобулинов
(1939) и тем самым обнаружена новая ф-ция Б. - защитная. Важным этапом
явилось открытие ферментативной ф-ции мышечного миозина (В. А. Энгельгардт,
М.Н.Любимова, 1939) и получение первых кристаллич. ферментов (уреазы-Дж.Б.
Салшер, 1926; пепсина - Дж.X. Нортроп, 1929; лизоцима - Э. П. Абрахам,
Р. Робинсон, 1937).
В нач. 50-х гг. была выдвинута идея о трех уровнях организации белковых
молекул (К. У. Линдерстрём-Ланг, 1952) - первичной, вторичной и третичной
структурах. Определены первичные структуры инсулина (Ф. Сенгер, 1953) и
рибонуклеазы (К. Анфинсен, С. Мур, К. Хёрс, У. Стайн, 1960). По данным
рентген ©структурного анализа были построены трехмерные модели миоглобина
(Дж. Кендрю, 1958) и гемоглобина (М, Перуц, 1958) и, т. обр., доказано
существование в Б. вторичной и третичной структур, в т. ч.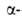 спирали, предсказанной Л. Допингом и Р. Кори в 1949-51.
спирали, предсказанной Л. Допингом и Р. Кори в 1949-51.
В 60-е гг. в химии Б. интенсивно развивалось синтетич. направление: были синтезированы инсулин (X. Цан, 1963, П. Кадоянис, 1964, Ю. Ван и др., 1965) и рибонуклеаза А (Б. Меррифидд, 1969). Дальнейшее развитие получили аналит. методы: стал широко использоваться автоматич. аминокислотный анализатор, созданный С. Муром и У. Стайном в 1958, существенно модифицированы хроматографич. методы, до высокой степени совершенства доведен рентгеноструктурный анализ, сконструирован автоматич. прибор для определения последовательности аминокислотных остатков в Б. - секвенатор (П. Эдман, Г. Бэгг, 1967). Благодаря созданию прочной методич. базы стало возможным проводить широкие исследования аминокислотной последовательности Б. В эти годы была определена структура неск. сотен сравнительно небольших Б. (до 300 аминокислотных остатков в одной цепи), полученных из самых разл. источников как животного, так и растит., бактериального, вирусного и др. происхождения. Среди них — протеолитич. ферменты (трипсин, химотрипсин, субтилизин, карбоксипептидазы), миоглобины, гемоглобины, цитохромы, лизоцимы, иммуноглобулины, гистоны, нейротоксины, Б. оболочек вирусов, белково-пептидные гормоны и др. В результате были созданы предпосылки для решения актуальных проблем энзимологии, иммунологии, эндокринологии и др. областей физ.-хим. биологии.
В 70-80-е гг. наиб. прогресс был достигнут при изучении Б. - регуляторов
матричного синтеза биополимеров (в т.ч. Б. рибосом), сократительных, транспортных
и защитных Б., ряда мембранных Б. (в т. ч. Б. биоэнергетич. систем), рецепторных
Б. Большое внимание уделялось дальнейшему совершенствованию методов анализа
Б. Значительно повышена чувствительность автоматич. анализа аминокислотной
последовательности Б. (Б. Витман-Либольд, Л. Худ). Широкое применение нашли
новые методы разделения Б. и пептидов (жидкостная хроматография высокого
давления, биоспецифич. хроматография). В связи с разработкой эффективных
методов анализа нуклеотидной последовательности ДНК (А. Максам и У. Гилберт,
Ф. Сенгер) стало возможным использовать полученную при таком анализе информацию
и при определении первичной структуры Б. В результате установлена структура
ряда Б., доступных в ничтожно малых кол-вах (интерферон, ацетилхолиновый
рецептор), а также Б. большой мол. массы (фактор элонгации G, гликогенфосфорилаза,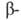 галактозидаза,
коллаген,
галактозидаза,
коллаген,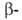 и
и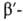 субъединицы
РНК-полимеразы, содержащие соотв. 701, 841, 1021, 1028, 1342 и 1407 аминокислотных
остатков). Успехи структурного анализа позволили вплотную приступить к
определению пространств, организации и молекулярных механизмов функционирования
надмолекулярных комплексов, в т.ч. рибосом, хроматина (нуклеосом), митохондрий,
фагов и вирусов. Существ, результаты получены в эти годы советскими учеными:
определена первичная структура аспартатаминотрансферазы (1972), бактериородопсина
(1978), животного родопсина (1982), нек-рых рибосомальных Б., фактора элонгации
G (1982), важнейшего фермента-РНК-полимеразы (1976-82), нейротоксинов и
др.
субъединицы
РНК-полимеразы, содержащие соотв. 701, 841, 1021, 1028, 1342 и 1407 аминокислотных
остатков). Успехи структурного анализа позволили вплотную приступить к
определению пространств, организации и молекулярных механизмов функционирования
надмолекулярных комплексов, в т.ч. рибосом, хроматина (нуклеосом), митохондрий,
фагов и вирусов. Существ, результаты получены в эти годы советскими учеными:
определена первичная структура аспартатаминотрансферазы (1972), бактериородопсина
(1978), животного родопсина (1982), нек-рых рибосомальных Б., фактора элонгации
G (1982), важнейшего фермента-РНК-полимеразы (1976-82), нейротоксинов и
др.
Строение белковых молекул. Практически все Б. построены из 20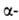 аминокислот,
принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены
между собой пептидными связями, образованными карбоксильной и
аминокислот,
принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены
между собой пептидными связями, образованными карбоксильной и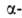 аминогруппами
соседних аминокислотных остатков (см. ф-лу I):
аминогруппами
соседних аминокислотных остатков (см. ф-лу I):
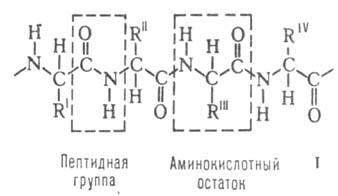
Белковая молекула может состоять из одной или неск. цепей, содержащих от 50 до неск. сотен (иногда - более тысячи) аминокислотных остатков. Молекулы, содержащие менее 50 остатков, часто относят к пептидам. В состав мн. молекул входят остатки цистина, дисульфидные связи к-рых ковалентно связывают участки одной или неск. цепей.
В нативном состоянии макромолекулы Б. обладают специфич. конформацией. Характерная для данного Б. конформация определяется последовательностью аминокислотных остатков и стабилизируется водородными связями между пептидными и боковыми группами аминокислотных остатков, а также гидрофобными и электростатич. взаимодействиями. Большое влияние на конформацию оказывают взаимод. Б. с компонентами среды (вода, липиды и др.), в к-рой они функционируют.
Различают четыре уровня организации белковых молекул. Последовательность
аминокислотных остатков в полипептидной цепи наз. первичной структурой.
Все Б. различаются по первичной структуре; потенциально возможное их число
практически неограничено. Термин "вторичная структура" относится к типу
укладки полипептидных цепей. наиб. часто встречающиеся типы-правая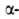 спираль и
спираль и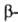 структура.
Первая характеризуется планарностью пептидной группы; водородные связи
между СО-и NH-группами пептидной цепи замыкают циклы из 13 атомов (рис.
1). На 1 виток
структура.
Первая характеризуется планарностью пептидной группы; водородные связи
между СО-и NH-группами пептидной цепи замыкают циклы из 13 атомов (рис.
1). На 1 виток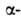 спирали
приходится 3,6 остатка аминокислот, шаг спирали -0,544 нм. Значительно
менее энергетически выгодны правые 310- и
спирали
приходится 3,6 остатка аминокислот, шаг спирали -0,544 нм. Значительно
менее энергетически выгодны правые 310- и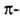 спирали,
содержащие соотв. 3 и 4,4 аминокислотных остатка на 1 виток, а также 10
и 16 атомов в циклах, образованных водородными связями. 310-Спирали
встречаются сравнительно редко и образуют только очень короткие участки,
к-рые обычно располагаются на концах
спирали,
содержащие соотв. 3 и 4,4 аминокислотных остатка на 1 виток, а также 10
и 16 атомов в циклах, образованных водородными связями. 310-Спирали
встречаются сравнительно редко и образуют только очень короткие участки,
к-рые обычно располагаются на концах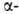 спиралей.
Предсказанные теоретически правые
спиралей.
Предсказанные теоретически правые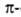 спирали,
а также левые
спирали,
а также левые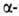 310- и
310- и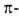 спирали
в Б. не обнаружены.
спирали
в Б. не обнаружены.
В случае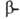 структуры,
или структуры складчатого листа, полипептидные цепи растянуты, уложены
параллельно друг другу и связаны между собой водородными связями. Остов
цепи не лежит в одной плоскости, а вследствие небольших изгибов при
структуры,
или структуры складчатого листа, полипептидные цепи растянуты, уложены
параллельно друг другу и связаны между собой водородными связями. Остов
цепи не лежит в одной плоскости, а вследствие небольших изгибов при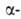 углеродных
атомах образует слегка волнистый слой. Боковые группы располагаются перпендикулярно
плоскости слоя. В Б. обнаружены два вида
углеродных
атомах образует слегка волнистый слой. Боковые группы располагаются перпендикулярно
плоскости слоя. В Б. обнаружены два вида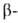 структуры:
с параллельным и антипараллельным направлениями цепей (рис. 2). Частный
случай
структуры:
с параллельным и антипараллельным направлениями цепей (рис. 2). Частный
случай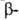 структуры-
структуры-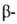 изгиб,
обеспечивающий поворот пептидной цепи на угол ок. 180° на протяжении отрезка,
содержащего 4 аминокислотных остатка; 1-й и 4-й остатки соединены водородной
связью. Относительное содержание
изгиб,
обеспечивающий поворот пептидной цепи на угол ок. 180° на протяжении отрезка,
содержащего 4 аминокислотных остатка; 1-й и 4-й остатки соединены водородной
связью. Относительное содержание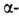 спиральных
участков и
спиральных
участков и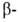 структур может широко варьировать. Существуют Б. с преобладанием
структур может широко варьировать. Существуют Б. с преобладанием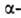 спиралей
(ок. 75% в миоглобине и гемоглобине), тогда как осн. тип структуры многих
фибриллярных Б., в т.ч. фиброина шелка и кератина волос,-
спиралей
(ок. 75% в миоглобине и гемоглобине), тогда как осн. тип структуры многих
фибриллярных Б., в т.ч. фиброина шелка и кератина волос,-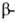 структура.
У многих Б. содержание
структура.
У многих Б. содержание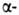 и
и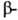 структурных
участков незначительно, однако и в этих случаях полипептидные цепи укладываются
в пространстве строго определенным, характерным для каждого Б. образом.
структурных
участков незначительно, однако и в этих случаях полипептидные цепи укладываются
в пространстве строго определенным, характерным для каждого Б. образом.
Под третичной структурой Б. понимают расположение его полипептидной
цепи в пространстве. Существ. влияние на формирование третичной структуры
оказывают размер, форма и полярность аминокислотных остатков. В молекулах
глобулярных Б. большая часть гидрофобных остатков скрыта внутри глобулы,
а полярные группировки располагаются на ее пов-сти в гидратированном состоянии.
Однако ситуация не всегда настолько проста. Связывание белка с др. молекулами,
напр. фермента с его субстратом или коферментом, почти всегда осуществляется
с помощью небольшого гидрофобного участка на пов-сти глобулы. Область контакта
мембранных Б. с липидами формируется преим. гидрофобными остатками. Третичная
структура многих Б. составляется из неск. компактных глобул, наз. доменами
(рис. 3). Между собой домены обычно бывают связаны "тонкими перемычками"
- вытянутыми полипептидными цепями. Пептидные связи, расположенные в этих
цепях, расщепляются в первую очередь при обработке Б. протеолитич. ферментами,
тогда как отдельные домены м. б. достаточно устойчивы к протеолизу.
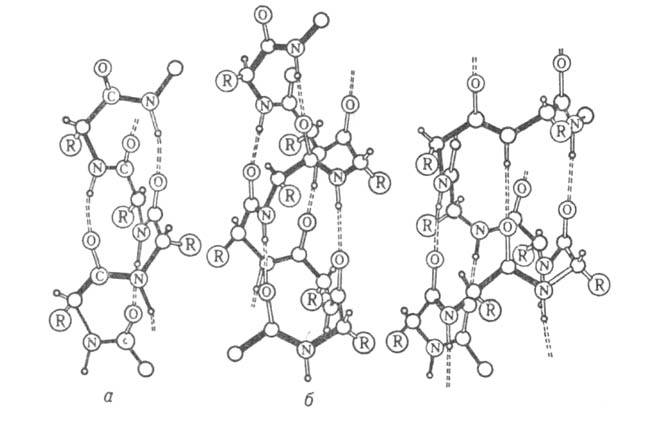
Рис. I. Спиральные конформации полипептидных цепей: а-310-спираль,
б-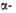 спираль,
в-
спираль,
в-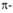 спираль (пунктирные
линии-водородные связи).
спираль (пунктирные
линии-водородные связи).
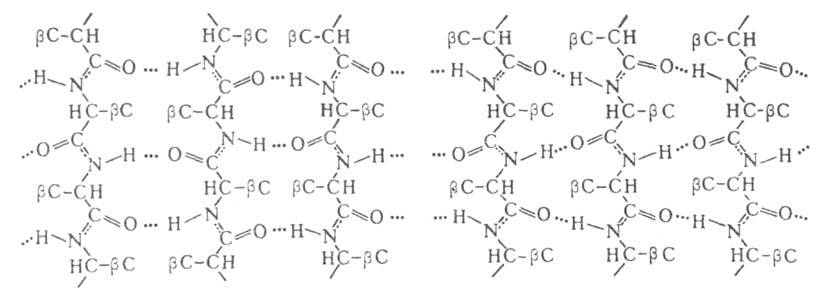
Рис. 2. Схематич. изображение структур:
слева - антипараллельный, справа - параллельный складчатый лист.
структур:
слева - антипараллельный, справа - параллельный складчатый лист.
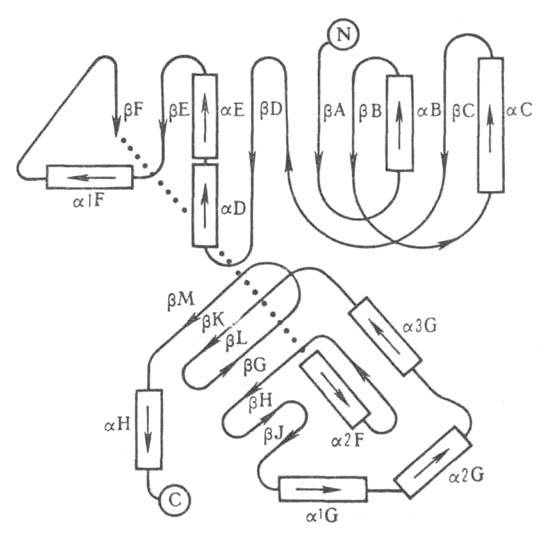
Рис. 3. Схематич. изображение трехмерной структуры малатде-гидрогеназы.
Участки спиралей
(от
спиралей
(от до
до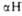 )
и
)
и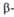 структур
(от
структур
(от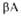 до
до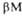 )
представлены соотв. в виде прямоугольников и прямых линий со стрелками.
Структура состоит из двух отчетливо различимых глобулярных областей (доменов).
Участок полипептидной цепи, соединяющий домены между собой, показан точечной
линией.
)
представлены соотв. в виде прямоугольников и прямых линий со стрелками.
Структура состоит из двух отчетливо различимых глобулярных областей (доменов).
Участок полипептидной цепи, соединяющий домены между собой, показан точечной
линией.
Термин "четвертичная структура" относится к макромолекулам, в состав к-рых входит неск. полипептидных цепей (субъединиц), не связанных между собой ковалентно. Такая структура отражает способ объединения и расположения этих субъединиц в пространстве. Между собой отдельные субъединицы соединяются водородными, ионными, гидрофобными и др. связями. Изменение рН и ионной силы р-ра, повышение т-ры или обработка детергентами обычно приводят к диссоциации макромолекулы на субъединицы. Этот процесс обратим: при устранении факторов, вызывающих диссоциацию, может происходить самопроизвольная реконструкция исходной четвертичной структуры. Явление носит общий характер: по принципу самосборки функционируют многие биол. структуры. Способность к самосборке свойственна и отдельным фрагментам Б. - доменам. Более глубокие изменения конформации Б. с нарушением третичной структуры наз. денатурацией.
Свойства. Физ.-хим. св-ва Б. определяются их высокомол. природой, компактностью укладки полипептидных цепей и взаимным расположением остатков аминокислот. Мол. масса варьирует от 5 тыс. до 1 млн., а константы седиментации - от 1 до 20 (и выше). Средний уд. объем белковых молекул - 0,70-0,75 см3/г, а константы диффузии - 106-108 см2/с. Максимум поглощения Б. в УФ-области спектра, обусловленный наличием ароматич. аминокислот, находится вблизи 280 им. Возбуждение электронов атома азота пептидной группы вызывает резкое увеличение поглощения при 185-240 нм. В ИК-области спектра Б. поглощают за счет СО- и NH-rpyпп при 1600 и 3100-3300 см-1.
В р-рах Б. амфотерны. Изоэлектрич. точки Б. могут иметь значения от < 1,0 (у пепсина) до 10,6 (у цитохрома с) и выше. Боковые группы аминокислотных остатков способны вступать во многие р-ции. Б. дают ряд цветных р-ций, обусловленных наличием определенных аминокислотных остатков или хим. группировок. К важнейшим из них относятся: биуретовая реакция (пептидные связи), ксантопротеиновая реакция (ароматич. ядра остатков тирозина, триптофана, фенилаланина), Адамкевича реакция (индольное кольцо триптофана), Мил лона реакция (фенольный радикал тирозина), Паули реакция (имидазольное кольцо гистидина), Сакагучи реакция (гуанидиновая группа аргинина) и нингидриновая реакция (аминогруппа).
Выделение. Один из первых этапов выделения Б. - получение соответствующих органелл (рибосом, митохондрий, ядер, цитоплазматич. мембраны) с помощью дифференциального центрифугирования. Далее Б. переводят в растворимое состояние путем экстракции буферными р-рами солей и детергентов, иногда - неполярными р-рителями. Затем применяют фракционное осаждение неорг. солями [обычно (NH4)2SO4], этанолом, ацетоном или путем изменения рН, ионной силы, т-ры. Для предотвращения денатурации работу проводят при пониж. т-ре (ок. 4°С); с целью исключения протеолиза используют ингибиторы протеаз, нек-рые Б. стабилизируют полиолами, напр. глицерином. Дальнейшую очистку проводят по схемам, специально разработанным для отдельных Б. или группы гомологичных Б. наиб. распространенные методы разделения-гель-проникающая хроматография, ионообменная и адсорбц. хроматография; эффективные методы-жидкостная хроматография высокого разрешения и аффинная хроматография.
Критерий чистоты Б. - гомогенность при электрофорезе, хроматографии и ультрацентрифугировании. Одноцепо-чечный Б. должен быть гомогенным при N- и С-концевом анализе (см. ниже). Примесь сопутствующих ферментов определяют с помощью специфич. субстратов; высокую чувствительность имеют иммунохим. методы (обычно до 10-3 мкг/мл примесного антигена).
Методы исследования первичной структуры. Знание первичной структуры Б.-основа для определения его вторичной и третичной структур, выяснения расположения функц. групп в активном центре Б. и построения модели его функционирования. Исследование первичной структуры мутантных Б. позволяет на молекулярном уровне характеризовать различия между штаммами микроорганизмов, фагов и вирусов, выяснять молекулярные причины генетич. болезней. Данные по первичной структуре используют при установлении и проверке таксономич. взаимоотношений между разл. видами живых организмов, построении фило-генетич. древа и анализе хода биол. эволюции.
Для определения аминокислотной последовательности Б. прежде всего разделяют его полипептидные цепи (если макромолекула состоит из неск. цепей). Затем определяют аминокислотный состав цепей, N- и С-концевые аминокислотные остатки и аминокислотные последовательности. Полипептидные цепи подвергают специфич. расщеплению протеолитич. ферментами или хим. реагентами. Смесь образовавшихся фрагментов разделяют и для каждого из них определяют аминокислотный состав и аминокислотную последовательность. При необходимости крупные фрагменты дополнительно расщепляют к.-л. способом на более мелкие. Порядок расположения фрагментов выясняют путем расщепления молекулы Б. по др. связям и анализа образующихся при этом "перекрывающихся" фрагментов.
Анализ аминокислотного состава включает полный гидролиз исследуемого Б. или пептида и количеств. определение всех аминокислот в гидролизате. Для гидролиза обычно используют 5,7 н. водный р-р НС1, а при анализе содержания триптофана - 4 н. метансульфоновую к-ту, содержащую 0,2% 3-(2-аминоэтил)индола, или кипячение со щелочью. Количеств. определение аминокислот в гидролизате проводят с помощью аминокислотного анализатора. В большинстве таких приборов смесь аминокислот разделяют на ионообменных колонках, детекцию осуществляют спектрофотометрически по р-ции с нингидрином или флуориметрически с использованием флуорескамина или о-фталевого диальдегида. В последнем случае можно анализировать до 0,1-0,05 нмоль аминокислоты.
Наиб. распространение для определения N-концевых остатков находит дансильный
метод. Его первая стадия -присоединение дансилхлорида (1-диметиламинонафталин-5-сульфохлорида)
к непротонированной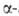 аминогруппе
с образованием дансилпептида (ДНС-пептида). Затем последний гидролизуют
5,7 н. р-ром НС1 при 105 °С, в результате чего освобождается N-концевая
аминогруппе
с образованием дансилпептида (ДНС-пептида). Затем последний гидролизуют
5,7 н. р-ром НС1 при 105 °С, в результате чего освобождается N-концевая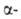 ДНС-аминокислота,
к-рая обладает интенсивной флуоресценцией в УФ-области спектра; для ее
идентификации достаточно 0,1-0,5 нмоля в-ва.
ДНС-аминокислота,
к-рая обладает интенсивной флуоресценцией в УФ-области спектра; для ее
идентификации достаточно 0,1-0,5 нмоля в-ва.
Для определения С-концевых остатков чаще всего используют ферментативный гидролиз карбоксипептидазами, к-рые специфически расщепляют пептидные связи, образованные С-концевыми остатками. Поскольку после отщепления концевых остатков фермент атакует послед. пептидные связи, измерение скорости отщепления отдельных аминокислот позволяет анализировать также и С-концевую аминокислотную последовательность.
Важнейший этап в определении первичной структуры Б. - расщепление макромолекулы на пептидные фрагменты. Среди ферментативных методов расщепления наиб. широко используется гидролиз трипсином. Трипсин обладает уникальной субстратной специфичностью: гидролизует исключительно связи, образованные карбоксильными группами осн. аминокислот - лизина и аргинина. Введение заместителей в боковые цепи лизина или аргинина препятствует гидролизу по остаткам модифициров. аминокислот и позволяет гидролизовать макромолекулы избирательно только по остаткам аргинина или лизина. Особенно часто используется модификация остатков лизина с послед. гидролизом Б. по остаткам аргинина. Модифицирующие агенты - ангидриды дикарбоновых к-т (янтарной, малеиновой и цитраконовой). Из др. протеолитич. ферментов широко применяется протеаза из Staphylococcus aureus (гидролизует связи, образованные карбоксильными группами остатков глутаминовой к-ты, а в нек-рых случаях и остатков аспарагиновой к-ты), а также химотрипсин и термолизин. Последние ферменты обладают более широкой специфичностью. Химотрипсин катализирует гидролиз пептидных связей, образованных карбоксильными группами ароматич. аминокислот - тирозина, фенилаланина и триптофана. С меньшей скоростью гидролизуются связи лейцина, метионина и гистидина. Термолизин преим. расщепляет связи, образованные аминогруппой остатков с гидрофобной боковой цепью (изолейцин, лейцин, валин, фенилаланин, тирозин, триптофан).
Из химических методов расщепления Б. наиболее специфичный и чаще всего
применяемый -бромциановое расщепление по остаткам метионина (выход 90-100%):
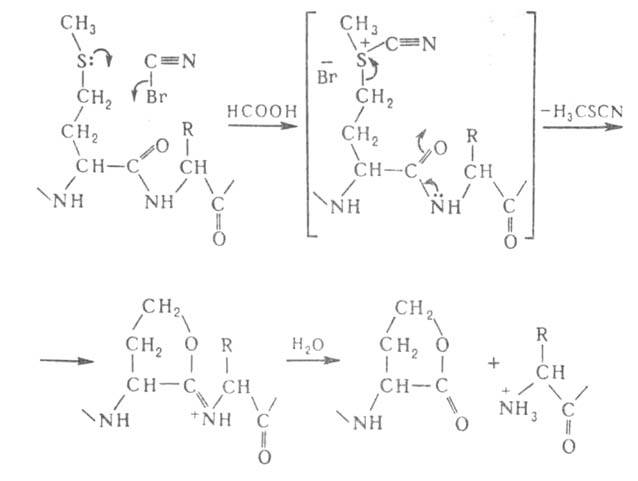
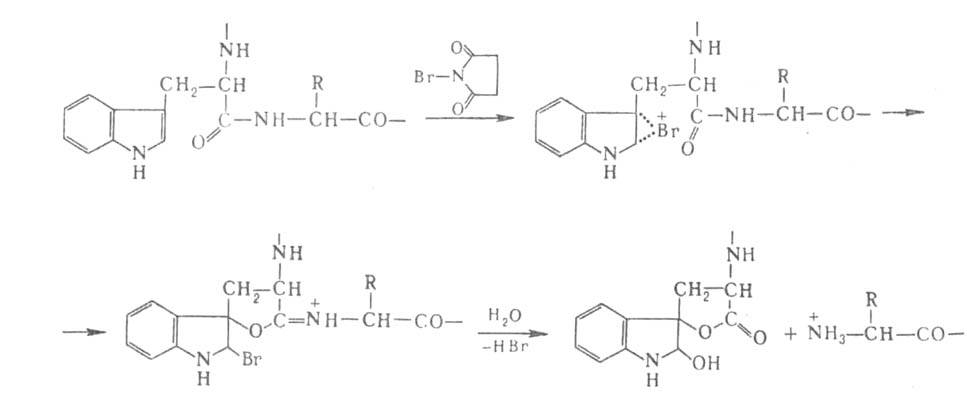
Для расщепления Б. по карбонильной группе остатка триптофана используют
N-бромсукцинимид или более селективный 2-(2-нитрофенилсульфенил)-3-метил-3-броминдол
(BNPS-скатол) (выход Ю-50%):
Гидроксиламин расщепляет пептидные связи между остатками аспарагина
и глицина. При его взаимод. с циклич. имидом ангидроаспартилглицина, спонтанно
образующегося из аспарагинилглицина, в щелочной среде происходит расщепление
пептидной цепи с образованием смеси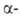 и
и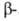 аспартилгидроксаматов:
аспартилгидроксаматов:
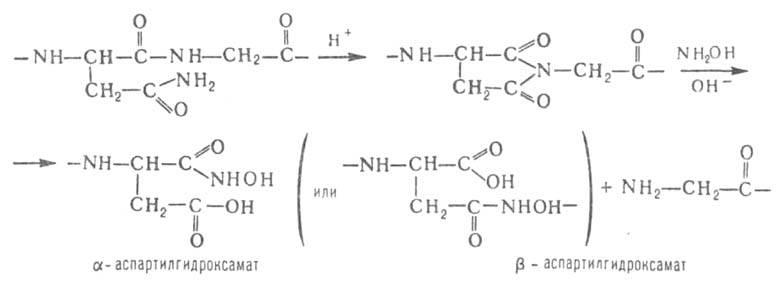
В ряде случаев для расщепления Б. используется метод частичного кислотного гидролиза. наиб. чувствительны к действию к-т аспартильные пептидные связи и особенно связь аспартил - пропил.
При выборе методов разделения пептидов учитывают физ.-хим. свойства, кол-во и длину молекул разделяемых соединений. Для первичного фракционирования смесей коротких пептидов, содержащих до 15-20 аминокислотных остатков, в большинстве случаев используют ионообменную хроматографию на катионитах. Дальнейшее разделение и очистку проводят с помощью хроматографии и электрофореза на бумаге или пластинках с тонким слоем целлюлозы или силикагеля.
Осн. сложность при фракционировании молекул крупных пептидов (более
20 аминокислотных остатков) - их св-во слипаться в водных р-рах друг с
другом с образованием высокомол. агрегатов, не поддающихся разделению.
Для предотвращения агрегации в буферные р-ры вводят мочевину (до 8 М),
гуанидинийхлорид (до 6 М) или детергенты (додецилсульфат Na); разделение
часто проводят с помощью гель-проникающей хроматографии и ионообменной
хроматографии. Эффективный метод разделения - жидкостная хроматография
высокого разрешения на носителях с обращенной фазой. Для селективного выделения
пептидов, несущих химически активные группировки, м. б. использована хемоспецифич.
(ковалентная) хроматография, основанная на образовании ковалентной связи
пептида с носителем. Напр., для выделения цистеинсодержащих пептидов используют
р-цию тиол-дисульфидного обмена, с помощью к-рой пептиды через дисульфидный
мостик присоединяются к модифицированному 2,2'-дипиридилдисульфидом носителю.
Ковалентно связанные с носителем цистеинсодержащие пептиды м. б. легко
элюированы при послед. обработке меркаптоэтанолом.
меркаптоэтанолом.
Осн. метод исследования аминокислотной последовательности пептидов и Б. - хим. деградация с помощью фенилизотиоцианата. Этот метод позволяет последовательно отщеплять N-концевые аминокислотные остатки в виде фенилтиогидантоинов, к-рые абсорбируют свет в УФ-области с максимумом поглощения 265-270 нм. Для их идентификации наиб. часто используют тонкослойную хроматографию, жидкостную хроматографию высокого давления, а также масс-спектрометрию. Широкое применение нашел также метод, сочетающий последовательную деградацию пептида по Эдману (см. Эдмана деградация) с анализом N-концевых аминокислотных остатков в виде их дансильных производных. Достоинство метода -его высокая чувствительность.
Для непосредственного анализа первичной структуры Б. обычно используют
секвенатор - прибор, к-рый с высокой эффективностью осуществляет последовательное
авто-матич. отщепление N-концевых аминокислотных остатков путем деградации
Б. по методу Эдмана. Все р-ции проводятся в цилиндрич. стеклянном стаканчике,
вращающемся с постоянной скоростью в атмосфере инертного газа (рис. 4).
Образец Б. распределяется на стенках стаканчика в виде тонкой пленки. Оптимизация
процесса и тщательная очистка используемых реагентов и растворителей позволили
поднять общий выход реакции до 95% и выше. Наилучшие объекты для секвенатора
- Б. и пептиды, содержащие в своем составе от 60 до 200 аминокислотных
остатков; для таких соединений обычно удается определять последовательность
30-35 (в ряде случаев 40-50) остатков. Для анализа коротких пептидов более
эффективен подход, заключающийся в их ковалентном присоединении к нерастворимому
носителю. Этот принцип положен в основу твердофазного секвенатора, где
реакц. "сосудом" служит хроматографич. колонка, с носителем к-рой ко валентно
связан исследуемый пептид. Через колонку последовательно пропускают реагенты
и р-рители. Носителями чаще всего служат полистирол и пористое стекло.
В кач-ве функц. группы, реагирующей с пептидом, обычно используется алифатич.
или ароматич. аминогруппа. Для присоединения к носителю пептидов, образующихся
в результате бромцианового расщепления, используют высокую реакц. способность
С-концевого лактона гомосерина. Лизинсодержащие пептиды м. б. присоединены
за счет аминогруппы
путем конденсации с n-фенилендиизотиоцианатом. Остальные пептиды присоединяют
по С-концевой карбоксильной группе карбодиимидным методом. Третье поколение
приборов - газофазные секвенаторы, в к-рых образец наносится на небольшой
(диаметр ок. 5 мм) диск из пористого стеклянного волокна, а все реагенты
подаются в газовой фазе. Таким способом анализируют микроколичество в-ва
( < 100 пкмоль).
аминогруппы
путем конденсации с n-фенилендиизотиоцианатом. Остальные пептиды присоединяют
по С-концевой карбоксильной группе карбодиимидным методом. Третье поколение
приборов - газофазные секвенаторы, в к-рых образец наносится на небольшой
(диаметр ок. 5 мм) диск из пористого стеклянного волокна, а все реагенты
подаются в газовой фазе. Таким способом анализируют микроколичество в-ва
( < 100 пкмоль).
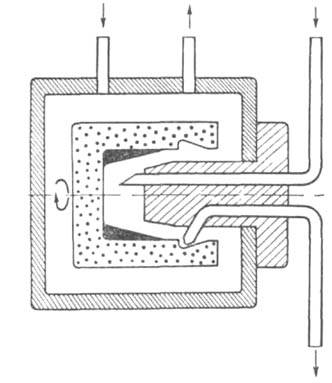
Рис. 4. Схема реакц. камеры секвенатора.
При определении аминокислотной последовательности пептидов находит применение
также масс-спектрометрия. В этом случае используется способность ионизиров.
молекул пептидов распадаться по т. наз. аминокислотному типу фрагментации,
заключающемуся в разрыве СО—NH или —СО связей:
—СО связей:
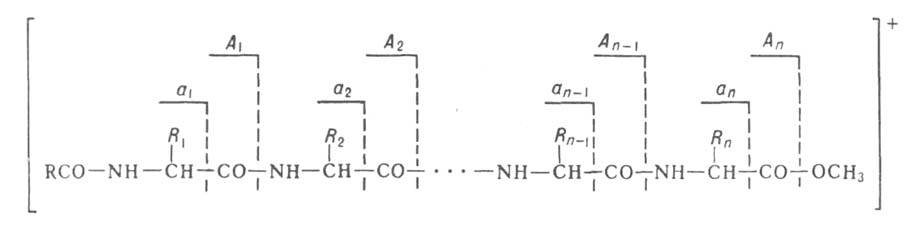
Идентификация в масс-спектре пиков, соответствующих фрагментам А1...Апили а1...ап, дает информацию о строении пептида.
Наиб. сложные проблемы возникают при изучении первичной структуры мембранных Б., а также Б., выделяемых в ничтожно малых кол-вах или имеющих большую мол. массу (> 100000). Ряд этих проблем решен благодаря разработке быстрых и эффективных методов анализа нуклеотидной последовательности ДНК. Поскольку первичная структура любого Б. закодирована в нуклеотидной последовательности соответствующего ей участка ДНК, то определение последней позволяет с помощью генетич. кода автоматически устанавливать и соответствующую аминокислотную последовательность. При этом оказалось особенно эффективным параллельное изучение первичных структур Б. и ДНК. Такой подход резко ускоряет проведение исследований и значительно повышает достоверность результатов.
Методы изучения пространственной структуры. При изучении пространств. структуры Б. существует два принципиальных подхода: исследование в р-ре и в кристаллич. состоянии. Осн. метод, дающий непосредственную информацию о пространств. расположении атомов в молекуле Б., - рентгеноструктурный анализ. Он применим только для хорошо кристаллизующихся Б. При этом наряду с кристаллом нативного Б. необходимо получать производные, содержащие тяжелые атомы, к-рые были бы изоморфными исходному Б., т.е. давали бы подобные кристаллич. структуры. Тяжелый атом вводится в молекулу Б. при "вымачивании" кристалла в соответствующем р-ре или в процессе кристаллизации. Иногда используют хим. модификацию Б., напр. n-хлормеркурийбензоатом по SH-группам.
Интерпретация карт электронной плотности молекулы значительно облегчается при знании аминокислотной последовательности. Однако далеко не каждый Б. удается получить в кристаллич. состоянии. Необходимое условие кристаллизации - сохранение нативной конформации, к-рая часто реализуется лишь в условиях, приближенных к физиологическим. В частности, Б., входящие в состав нуклеопротеидных комплексов (рибосома, вирусы), хорошо кристаллизуются только в составе таких комплексов. С помощью обычного рентгеновского излучения проводить анализ таких гигантских образований сложно. В этих случаях используют синхротронное рентгеновское излучение, интенсивность к-рого может быть на два порядка выше. Вследствие этого резко сокращается время эксперимента по регистрации дифракц. отражений, а также снижается кол-во исследуемого в-ва. Ряд мембранных Б. кристаллизуется в условиях нативного липидного окружения с образованием т. наз. "двухмерных" кристаллов, представляющих из себя регулярно упакованные молекулы Б. в бислойной лииидной мембране. При изучении двухмерных кристаллов используют электронную микроскопию и электронографию.
Во мн. случаях хорошие результаты получают, применяя нейтронографию. Нейтроны, имея низкую энергию, в отличие от рентгеновских лучей не разрушают кристаллы Б., в результате чего можно получить полный набор дифракц. данных от одного кристалла. С использованием этого метода удается локализовать в структуре Б. отдельные атомы водорода, а также расположение молекул кристаллизац. воды.
В общем случае конформация Б. в кристалле может отличаться (обычно весьма
незначительно) от конформации в р-ре. Поэтому наряду с исследованием кристаллов
проводят изучение Б. и в его прир. среде. Существует набор методов исследования
пространств. структуры Б. в р-ре. наиб. часто используемые - оптич. методы
(УФ-, ИК- и Раман-спектроскопия, круговой дихроизм, флуоресценция), ЯМР
и ЭПР. Ни одним из этих методов в отдельности, как правило, невозможно
определить конформацию Б., тогда как их комбинация в ряде случаев дает
информацию, к-рая сравнима по ценности с рентгеноструктурным анализом.
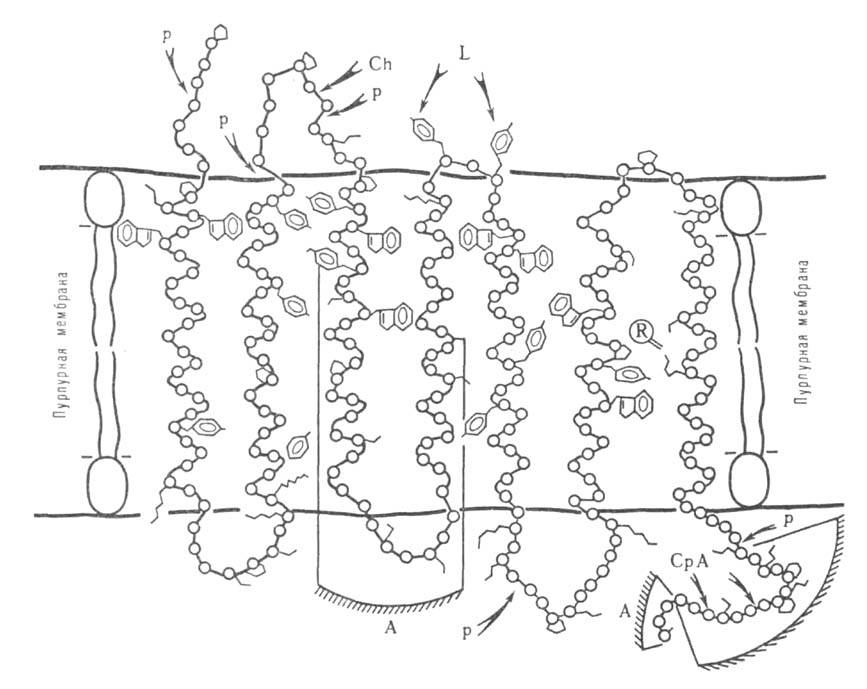
Рис. 5. Расположение молекулы бактериородопсина в пурпурно" мембране. Участки полипептидной цепи, доступные для иодирования лактопероксидазой-L, протеолиза папаином-Р, химотрипсином-Ch и карбоксипептидазой А - СрА. А-антигенные детерминанты.
Оптич. методы позволяют следить за изменениями конформации Б. в процессе функционирования или при изменении окружающих условий. Комбинация этих методов дает информацию об относит. содержании в Б. элементов вторичной структуры, о расположении остатков триптофана относительно пов-сти белковой глобулы и о конфигурации связей С—S—S—С в дисульфидных мостиках.
Прямую информацию о пространств. строении Б. в р-ре дает метод ЯМР.
Совр. методики ЯМР-спектроскопии позволяют проводить практически полное
отнесение сигналов в спектрах пептидов и небольших Б. (с мол. м. до 10.000)
к определенным ядрам в молекуле. Использование гомоядерных (1Н—1H)
и гетероядерных (*Н—13C) констант спин-спинового взаимод. дает
возможность определять торсионные углы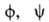 и
и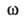 осн.
полипептидной цепи и торсионный угол х' боковых цепей аминокислотных остатков.
С помощью ядерного эффекта Оверхаузера, сдвиговых и уширяющих реагентов
(ионы парамагн. металлов, спиновые метки) измеряют расстояния между отдельными
ядрами молекулы. Т. обр. для пептидов и небольших Б. удается определить
пространств. структуру с разрешением до 0,3-0,4 нм. Несомненное достоинство
ЯМР-спектроскопии - возможность получать информацию о динамике пространств.
структуры молекулы Б.
осн.
полипептидной цепи и торсионный угол х' боковых цепей аминокислотных остатков.
С помощью ядерного эффекта Оверхаузера, сдвиговых и уширяющих реагентов
(ионы парамагн. металлов, спиновые метки) измеряют расстояния между отдельными
ядрами молекулы. Т. обр. для пептидов и небольших Б. удается определить
пространств. структуру с разрешением до 0,3-0,4 нм. Несомненное достоинство
ЯМР-спектроскопии - возможность получать информацию о динамике пространств.
структуры молекулы Б.
Модификация Б. реагентами, несущими своб. радикал (спиновая метка) или флуоресцентную группировку, позволяет судить о хим. окружении модифицируемой группы, а при наличии в Б. двух таких меток - измерить расстояние между ними.
Теоретически возможно предсказывать в общем виде пространств. строение Б., исходя из его аминокислотной последовательности. Такого рода расчеты проводят с помощью ЭВМ на основании закономерностей, выведенных в результате статистич. обработки данных для Б. с установленной пространств. структурой. В ряде случаев расчетные методы дают удовлетворительные результаты, к-рые помогают интерпретировать данные, полученные др. методами.
При исследовании пространств. структуры Б. часто используют ограниченный протеолиз, проводящийся в мягких неденатурирующих условиях, в к-рых гидролизуются исключительно пептидные связи, находящиеся на пов-сти глобулы Б. Таким путем получают информацию о доменной структуре Б. В случае мембранных Б. этим методом удается различить участки полипептидной цепи, расположенные внутри мембраны и на ее пов-сти (рис. 5). Аналогичную по характеру, но значительно более детальную информацию получают при изучении взаимод. Б. и их отдельных фрагментов с антителами.
Синтез. Биосинтез Б. происходит в результате трансляции в субклеточных частицах - рибосомах, представляющих собой сложный рибонуклеопротеидный комплекс. Информация о первичной структуре Б. "хранится" в соответствующих генах - участках ДНК - в виде последовательности нуклеотидов. В процессе транскрипции эта информация с помощью фермента - ДНК-зависимой РНК-полимеразы - передается на матричную рибонуклеиновую к-ту, к-рая, соединяясь с рибосомой, служит матрицей для синтеза Б. Выходящие из рибосомы синтезированные полипептидные цепи, самопроизвольно сворачиваясь, принимают присущую данному Б. конформацию, а также подвергаются модификации благодаря р-циям разл. функциональных групп аминокислотных остатков и расщеплению пептидных связей (см. Модификация белков).
Хим. синтез широко применяют для получения пептидов, в т.ч. биологически активных гормонов и их разнообразных аналогов, используемых для изучения взаимосвязи структуры и биол. функции, а также пептидов, несущих антигенные детерминанты разл. Б. и применяемых для приготовления соответствующих вакцин. Первые хим. синтезы Б. в 60-е гг. (инсулина овцы и рибонуклеазы SX осуществленные в р-ре с помощью тех же методов, к-рые используют при синтезе пептидов, были связаны с чрезвычайно большими сложностями. В каждом случае требовалось провести сотни хим. р-ций и окончательный выход Б. был очень низок (менее 0,1%), в результате чего полученные препараты не удалось очистить. Позже были синтезированы нек-рые химически чистые Б., в частности инсулин человека (П. Зибер и др.) и нейротоксин II из ядра среднеазиатской кобры (В. Т. Иванов). Однако до сих пор хим. синтез Б. представляет весьма сложную проблему и имеет скорее теоретич., чем практич. значение. Более перспективны методы генетической инженерии, к-рые позволяют наладить пром. получение практически важных Б. и пептидов.
Значение белков в питании. Б.-необходимая составная часть продуктов питания. Проблема пищевого Б. стоит очень остро. По данным Международной организации по продовольствию и с. х-ву при ООН больше половины человечества не получает с пищей необходимого кол-ва Б. Недостаток Б. в пище вызывает тяжелое заболевание - квашиоркор.
В процессе пищеварения Б. подвергаются гидролизу до аминокислот, к-рые и всасываются в кровь. Пищ ценность Б. зависит от их аминокислотного состава, содержания в них т. наз. незаменимых аминокислот, не синтезирующихся в организмах (для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин). В питательном отношении растит. Б. менее ценны. чем животные; они беднее лизином, метионином и триптофаном, труднее перевариваются. Один из путей решения проблемы - добавление в растит. пищу синтетич. аминокислот. Наряду с этим выводят новые сорта растений, содержащие гены, ответственные за синтез недостающих аминокислот. Перспективно использование для этого методов генетич. инженерии. Чрезвычайно важное значение имеет широкое внедрение пром. микробиологического синтеза, напр. выращивание дрожжей на гидролизном этиловом спирте, прир. газе или нефти. Получаемые при этом белково-витаминные концентраты (БВК) используют в качестве добавок к корму с.-х. животных. Исследования советских микробиологов и технологов (Г. К. Скрябин и др.) послужили основой для производства БВК в СССР в крупных масштабах.
Лит.: Бэйли Дж., Методы химии белков, пер. с англ., М., 1965; Новые методы анализа аминокислот, пептидов и белков, пер. с англ.. М., 1974; Дэвени Т., Гергей Я., Аминокислоты, пептиды и белки, пер. с англ., М., 1976; Ш а м ин А. Н., История химии белка, М., 1977; У айт А. [и др.], Основы биохимии, т. 1-3, пер. с англ., М., 1981; Лени нджер А., Основы биохимии, т. 1-3, пер. с англ., М., 1975; Я кубке Х.-Д., Ешкайт X., Аминокислоты, пептиды, белки, пер. с нем., М 1985; Advances in protein chemistry, v. 1-33, N.Y., 1944-79; Methods in enzymology, v. 11. ed. by S. P. Cofowick, N.O. Kaplan, N.Y.-L, 1967; то же, v. 25, pt B, ed. by C.H.W. Hirs, S. N. TimashefT, N.Y.-L., 1972; Protein sequence determination. A sourcebook of methods and techniques, ed. by S. B. Needleman, 2 ed.. В., 1975; The proteins, ed. by H. Neurath, R.L. Hill, 3 ed., 1-4, N. Y.-[a.o.], 1975-79; Methods in protein sequence analysis, ed. by M. Elzinga. Clifton, 1982. Ю. А. Овчинников.


