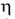 1,67 мПа*с (25°С), 1,24 мПа*с (50°С);
1,67 мПа*с (25°С), 1,24 мПа*с (50°С);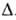 Н°исп
38,9 кДж/моль,
Н°исп
38,9 кДж/моль,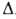 Н°пл
16,7 кДж/моль; р-римость в воде 0,55% по массе (20°С), р-римость воды в
А. 1,65%; хорошо раств. в этаноле, эфире, ацетоне, хлороформе, бензоле.
Н°пл
16,7 кДж/моль; р-римость в воде 0,55% по массе (20°С), р-римость воды в
А. 1,65%; хорошо раств. в этаноле, эфире, ацетоне, хлороформе, бензоле.
А. обладает всеми хим. св-вами, характерными для жирноароматич. кетонов.
Атомы водорода метальной группы достаточно подвижны. Так, при хлорировании
А. образуется хлорацетофенон
С1СН2СОС6Н5; продукты кротоновой конденсации
- дипнон (формула I) и трифенилбензол (II).
хлорацетофенон
С1СН2СОС6Н5; продукты кротоновой конденсации
- дипнон (формула I) и трифенилбензол (II).
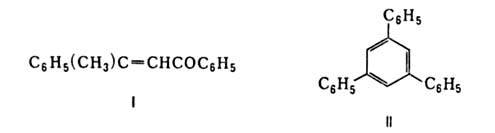
В присут. NaNH2 А. образует енолят CH2=C(ONa)C6H5,
к-рый ацилируется эфирами хлоругольной к-ты, превращаясь в эфиры CH2=C(C6H5)OCOOR.
А. способен к замещению в ароматич. ядре, напр. при нитровании дает м-нитроацетофенон.
Не присоединяет NaHSO3. Под действием LiAlH4 или
при гидрировании на меднохромовом катализаторе восстанавливается в фенилэтиловый
спирт С6Н5СН(ОН)СН3.
фенилэтиловый
спирт С6Н5СН(ОН)СН3.
В пром-сти А. получают: по р-ции Фриделя-Крафтса из бензола и ацетилхлорида
или уксусного ангидрида в присут. А1С13 или FеС13
(выход 85%); жидкофазным окислением этилбензола О2 воздуха при
115-120°С (кат. - бензоаты Со, Сu, Mn, Ni, Pb или Fe) с выходом 80%, основной
побочный продукт (16%)- фенилэтиловый
спирт.
фенилэтиловый
спирт.
А. и его замещенные, напр. n-метилацетофенон СН3СОС6Н4СН3 (т. пл. -23°С, т. кип. 227°С; d420 1,002, nD20 1,5335; запах мимозы), и-метоксиацетофенон СН3ОС6Н4СОСН3 (т. пл. 39°С, т. кип. 258°С; d441 1,082; запах цветов гелиотропа), - душистые в-ва в парфюмерии. А. обладает снотворным действием.
Лит.: Кружалов Б. Д., Голованенко Б. И., Совместное получение
фенола и ацетона, М., 1963; Несмеяно в А. Н., Несмеянов Н. А., Начала органической
химии, кн. 2, М., 1970. с. 148-59. Ю.Н. Юрьев.


