Сухая А. к. протекает по механизму низкотемпературного окисления, включающему след. стадии: хемосорбция О2 и Н2О на пов-сти металла с их диссоциацией; образование зародышей кристаллизации оксидов и гидроксидов металла, тангенциальный рост кристаллов, слияние и образование сплошной, частично гидратированной оксидной пленки. При толщине пленки 2-5 нм дальнейшее окисление металла в чистой (без примесей) атмосфере прекращается.
Влажная А.к. развивается при относит. влажности выше критической, т.е. > 70% для чистой атмосферы, когда на пов-сти металла возникает тонкая (от 2-3 до десятков молекулярных слоев) адсорбц. пленка воды, и происходит по электрохим. механизму. Катодная р-ция имеет вид:
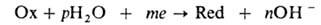 "
"
где п, m, р-стехиометрич. коэф. электрохим. восстановления, Ох - О2, О3, Н2О2 и др. окислители, Red - их восстановленная форма (м. б. заряженной). Металл М окисляется по анодной р-ции:
 Э
Э
где Az- - анион (ОН-, SO42-, Cl- и др.), образующийся при растворении в воде примесей. В чистой атмосфере продукты анодной р-ции - труднорастворимые гидроксиды, из к-рых формируется плотная защитная пленка, препятствующая дальнейшему развитию А. к. (металл пассивируется). Примеси, способные растворяться в воде, активируют анодную р-цию вследствие образования легкорастворимых солей. Поэтому скорость влажной А. к. в загрязненной атмосфере в сотни и тысячи раз больше, чем в чистой.
Мокрая А. к. наблюдается при возникновении на пов-сти металла фазовой (капельно-жидкой) пленки воды в результате выпадения дождя, конденсации атм. влаги (роса) или осаждения тумана и протекает по такому же электрохим. механизму коррозии, как и в объемах электролитов. В начальных стадиях скорость А. к. трудно пассивирующихся металлов определяется скоростью катодной р-ции, но по мере накопления продуктов анодного растворения ионизация металла замедляется и скорость А.к. уменьшается. Увеличение концентрации примесей в пленке воды стимулирует коррозию.
В реальных условиях наблюдаются все рассмотренные виды А. к. Защитные св-ва слоя продуктов А. к., предохраняющего металл от дальнейшего разрушения, можно усилить легированием металла Ni, Си, Сг (низколегированные атмосферостойкие стали, сплавы на основе Сu, А1 и др.). Для А.к. характерны все виды коррозионного разрушения: равномерное, язвенное, питтинговое, щелевое, межкристаллитное, коррозионное растрескивание и др. По стойкости к А. к. металлы и сплавы образуют ряд в такой же последовательности, как и по стойкости к коррозии в нейтральных электролитах, а именно: благородные металлы, легко пассивирующиеся металлы (Ti, A( Zr), конструкц. сплавы на основе Fe, Ni, Cu, Cd.
Для техн. целей коррозионную агрессивность атмосферы оценивают по климатич.
характеристикам и загрязненности. Осн. климатич. характеристика - продолжительность
сохранения на металлах адсорбционных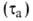 или фазовых
или фазовых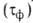 пленок воды. Соотв. различают климат сухой (
пленок воды. Соотв. различают климат сухой (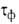 500 ч/год), умеренно влажный (500 <
500 ч/год), умеренно влажный (500 <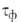 <
2500) и влажный (
<
2500) и влажный (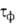 >
2500). Скорость А.к. [г/(м2*год)] приближенно рассчитывают по
ур-нию:
>
2500). Скорость А.к. [г/(м2*год)] приближенно рассчитывают по
ур-нию:
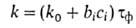 9
9
где k0- скорость коррозии металла в сельской (условно чистой) атмосфере, bi,-ускорение коррозии примесью частиц i-ro сорта, ci-концентрация этой примеси. Реальная скорость А. к. низкоуглеродистой стали от 30 (в сухой сельской атмосфере) до 8000 (в морской атмосфере), меди - от 1,7 до 65, цинка - от 1 до 95 г/(м2*год).
Металлы защищают от А. к. с помощью гальванич., металлизационных и лакокрасочных покрытий. Широко используют консервацию смазками и полимерными покрытиями, применяют летучие и контактные ингибиторы коррозии.
Лит.: Розенфельд И. Л., Атмосферная коррозия металлов, М., 1960;
Михайловский Ю. Н., в кн.: Итога науки и техники. Коррозия и защита от
коррозии, т. 3, М., 1974, с. 153-205; Михайловский Ю. Н. [и др.]. "Защита
металлов", 1980, т. 16, в. 4, с. 396-413. Ю.Н. Михайловский.


