АСПАРТАТАМИНОТРАНСФЕРАЗА (L-аспартат : 2-оксо-глутарат аминотрансфераза),
фермент класса трансфераз, катализирующий при участии кофермента пиридоксаль-5'-фосфата
обратимый перенос аминогруппы (трансаминирование) от L-аспарагиновой к-ты
(ф-ла I) на 2-оксоглутаровую (II) с образованием щавелевоуксусной (III)
и L-глутаминовой (IV) к-т. Р-ция трансаминирования состоит из двух полуреакций;
на промежут. этапе образуется пиридоксамин-5'-фосфат (V):
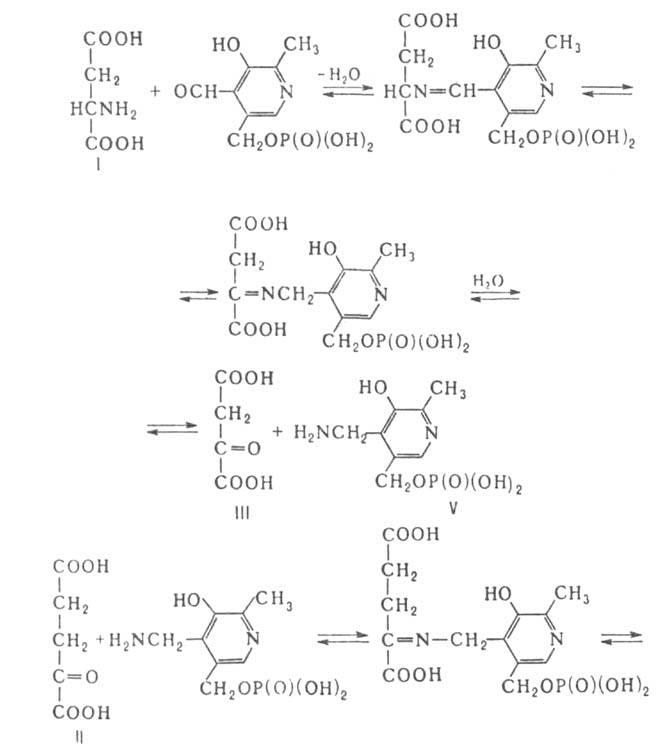
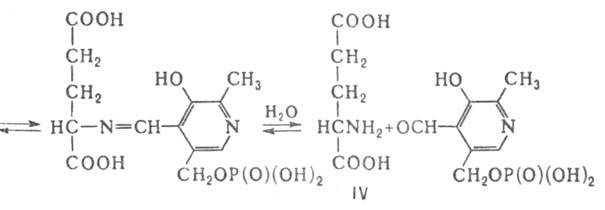
В тканях позвоночных А. существует в виде двух форм (изоферментов)-цитозольной
(мол.м. 92,6 тыс.) и митохондриальной (мол.м. 89,8 тыс.); их изоэлектрич.
точки соотв. 6 и 9. Оптимальная каталитич. активность А. при рН 8,0-8,5.
Определены первичная и трехмерная структуры обоих изоферментов. Они состоят
из 2 идентичных субъединиц, к-рые построены из 2 доменов - большого, связывающего
кофермент, и малого подвижного; между ними расположен активный центр. Взаимодействие
с субстратом сопровождается сдвигом малого домена в сторону активного центра
и поворотом пиридинового кольца кофермента на ~ 30°. Кофермент прочно связан
с апоферментом через остаток фосфорной к-ты, фенольную и альдегидную группы
и атом N. Его альдегидная группа образует основание Шиффа с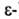 NH2-группой
остатка лизина в белке, что обусловливает ярко-желтую окраску А. в кислой
среде (
NH2-группой
остатка лизина в белке, что обусловливает ярко-желтую окраску А. в кислой
среде (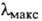 430
нм); в щелочной среде А. почти бесцветна (
430
нм); в щелочной среде А. почти бесцветна (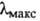 362 нм). А. из митохондрий катализирует также трансаминирование с участием
L-тирозина, L-триптофана и L-фенилаланина; скорость этого процесса в 200-1000
раз меньше, чем в основной р-ции.
362 нм). А. из митохондрий катализирует также трансаминирование с участием
L-тирозина, L-триптофана и L-фенилаланина; скорость этого процесса в 200-1000
раз меньше, чем в основной р-ции.
Ингибируется А. гидроксиламином, гидразином и их производными, а также циклосерином, серин-О-сульфокислотой, пропаргилглицином и нек-рыми двухосновными к-тами. Фермент обнаружен у млекопитающих, птиц, растений и микроорганизмов. Активность А. в крови человека резко возрастает при инфаркте миокарда, что используется для диагностич. целей.
Лит.: Вгаunstein А. Е., в кн.: Enzymes, ed. by P.O. Boyer, 3
ed, v. 9, N.Y., 1973, pi 379-481; Transaminases, ed. by P. Christen, D.E.
Metzler, N.Y., 1984. Ю.М. Торчтский.


