АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ, характеризуются наличием ароматич. системы связей (см. Ароматичность). В более узком смысле к А. с. относят только бензоидные соед., т.е. бензол, би-, три- и полициклич. соед., построенные из конденсированных или неконденсированных бензольных ядер, и их производные (ароматич. углеводороды наз. аренами).
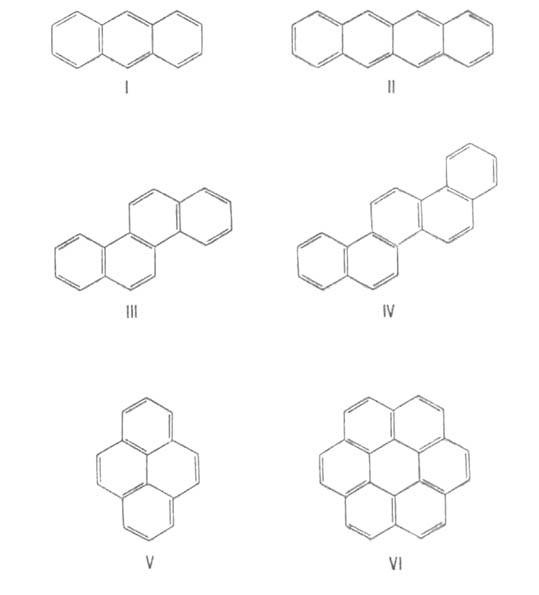
В конденсир. А.с. два соседних "срощенных" цикла имеют два общих атома.
При этом возможны три типа сочленения циклов: линеарное, или линейное,
как в антрацене (ф-ла I) и тетрацене (II); ангулярное, или угловое, напр.
в фенантрене, хризене (III), пицене (IV); пери-сочленение, отличающееся
наличием атомов С, общих для трех циклов, как в пирене (V) и коронене (VI).
В случае пери-сочленения общее число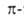 электронов
не отвечает правилу Хюккеля (4л + 2) и, следовательно, соответствующие
соед. не должны относиться к ароматическим. Однако в них можно выделить
отдельные составляющие их моноциклич. А. с. (обычно с шестью
электронов
не отвечает правилу Хюккеля (4л + 2) и, следовательно, соответствующие
соед. не должны относиться к ароматическим. Однако в них можно выделить
отдельные составляющие их моноциклич. А. с. (обычно с шестью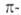 электронами)
или рассматривать
электронами)
или рассматривать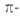 электронные оболочки по периметру полициклич. системы; если они включают
10, 14, 18 и т.д.
электронные оболочки по периметру полициклич. системы; если они включают
10, 14, 18 и т.д.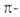 электронов,
то в соответствии с правилом Хюккеля их относят к ароматическим. Таким
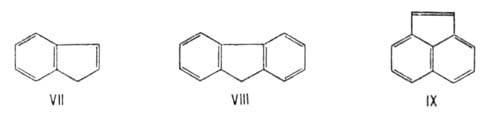
же образом можно рассматривать конденсир. А. с., включающие не только шестичленные
циклы, напр. инден (VII), флуорен (VIII), аценафтилен (IX):
электронов,
то в соответствии с правилом Хюккеля их относят к ароматическим. Таким
же образом можно рассматривать конденсир. А. с., включающие не только шестичленные
циклы, напр. инден (VII), флуорен (VIII), аценафтилен (IX):
Кроме первых членов ряда, напр. бензола, нафталина, антрацена, к А. с. относятся также их замещенные (гомологи, галогензамешенные, нитросоединения, амины, фенолы, карбонильные соед. и др.). Одним из важных типов А. с. являются жирноароматич. соединения - гомолога А.с. и их производные с заместителями в алкильных группах, напр. бензилхлорид С6Н5СН2С1, фенилуксусная к-та С6Н5СН2СООН.
По номенклатуре ИЮПАК и в соответствии с традицией моноциклич. А.с.
рассматривают как производные бензола: С6Н5С2Н5-этилбензол,
С6Н5С1 - хлорбензол, С6Н5СООН
- бензойная к-та, С6Н58О2С1 - бензолсульфохлорид
и т.д.; для нек-рых сохранены тривиальные назв.: толуол, ксилол, мезитилен,
кумол, цимол, стирол, анилин, фенол, крезол. Назв. неконденсированных полициклических
А.с. строятся по заместительному или соединительному типу, напр. С6Н5СН2С6Н5
- дифенилметан, С6Н5С6Н5 -
бифенил, C6H5C6H4C6H5
- тepенил. Многие конденсир. А. с. имеют тривиальные назв., напр.
нафталин, антрацен, фенантрен; назв. более сложных систем основаны на этих
тривиальных назв. с до.бавлением соответствующей приставки и индекса (в
квадратных скобках), указывающего место конденсации, напр.:
А.с.-жидкости или твердые в-ва, отличающиеся от своих алифатич. и алициклич.
аналогов более высокими показателями преломления и поглощением в близкой
УФ- или видимой области спектра. Для них характерно наличие т. наз. магнитного
кольцевого тока и поглощение в слабопольной ("ароматической") части спектра
ЯМР (область 6,5-8,0 м. д. для 1Н и 110-170 м.д. для 13С).
Для А.с. характерны р-ции замещения. Наиб. изучено и важно электроф.
замещение, прежде всего галогенирование, нитрование, сулъфирование, алкилирование
и ацилирование по Фриделю-Крафтсу. Эти р-ции облегчаются и направляются
преим. в орто- и пара-положения при наличии в А. с. заместителей
- ориентантов I рода (Alk, Аг, OR, NR2, SR, F, Cl, Br, I) и
затрудняются и направляются преим. в мета-положение ориентантами II рода
(COR, COOR, CN, NO2, SO2R, SO3H). Электроф.
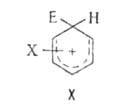
замещение осуществляется по механизму "присоединения - отщепления", обычно
включающему образование катионного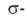 комплекса
(ф-ла X, где X - заместитель в А.с., ориентант I или II рода; Е - входящая
группа), наз. также интермедиатом Уэланда.
комплекса
(ф-ла X, где X - заместитель в А.с., ориентант I или II рода; Е - входящая
группа), наз. также интермедиатом Уэланда.
Для А.с. характерно также нуклеоф. замещение при действии N-, О-, S-,
С-нуклеофилов, напр. NR2, RO-, RS-, (RCO)2CH-,
а также анионов галогенов (наиб. важны р-ции с F ~ ). При этом замещаемой
группой могут служить атомы галогенов, нитро-, амино-, гидрокси-, алкокси-,
алкилтио- и сульфогруппы, реже - атомы водорода. Такие р-ции часто реализуются
в жестких условиях, напр. щелочное плавление солей сульфокислот проводят
при т-pax порядка 300-400°С (в расплаве щелочи при атм. давлении или в
водном р-ре щелочи при повыш. давлении): ArSO3Na + 2NaOH
-> ArONa + Na2SO3 + H2O. Р-ции облегчаются
в присут. соединений Си и особенно при наличии в орто- или пара-положении
к уходящей группе ориентантов II рода.
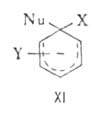
Нуклеоф. замещение может протекать по разл. механизмам. наиб. известный
- "присоединение - отщепление", включающий образование анионного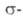 комплекса
(XI), наз. комплексом Майзенхаймера. Может осуществляться также радикально-нуклеоф.
замещение с промежут. образованием ароматич. анионрадикалов, генерируемых
из арилгалогенидов фотохимически или электрохимически:
комплекса
(XI), наз. комплексом Майзенхаймера. Может осуществляться также радикально-нуклеоф.
замещение с промежут. образованием ароматич. анионрадикалов, генерируемых
из арилгалогенидов фотохимически или электрохимически:
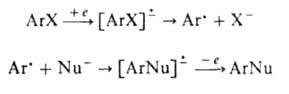
(е- электрон).
Известны также механизмы "отщепления - присоединения". Напр., при действии
металлич. Li или алкиллития, напр. BuLi, на о-дигалогенбензолы или
при фотолизе о-диазобензойных к-т образуются нестабильные и весьма реакционноспособные
дегидроароматич. соед. (арины). Конечный продукт нуклеоф. замещения ArNu
образуется в таких случаях в результате присоединения нуклеофила по тройной
связи. В случае несимметричных соед. образуются смеси двух продуктов:
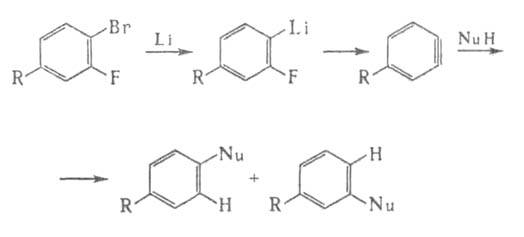
Поляризация тройной связи обеспечивает селективное присоединение нуклеофила
к литийаринам, к-рые образуются, напр., при отщеплении сульфинатов Li или
производных H2SO3 от 2,6-дилитийсульфонилбензолов:
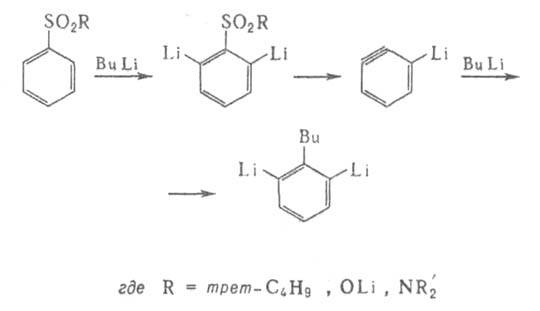
Меньшее значение имеет гомолитич. замещение А. с., напр. арилирование
диазосоединениями и гидроксилирование действием реагента Фентона (Н2О2
+ CuSO4 + H2SO4). А.с. могут подвергаться
также прямому металлированию. Особенно важны литирование по механизму протофильного
замещения и меркурирование, являющееся р-цией электроф. замещения. А. с.
могут обменивать галоген на металл (при действии металлов или металлоорг.
соед.). С переходными металлами они образуют металлоарены (ареновые комплексы),
напр. дибензолхром.
комплексы),
напр. дибензолхром.
Р-ции А.с. по замещающим группам в целом подобны р-циям соответствующих алифатич. соед., однако имеются и существ. особенности. Так, ароматич. амины образуют с HNO2 устойчивые диазосоединения, способные к азосочетанию и превращающиеся при действии нуклеофилов в разнообразные замещенные А. с., напр. по р-ции Зандмейера. Двойные соли, образуемые галогенидами арилдиазония и галогенидами разл. металлов, при действии порошка Си, Zn или Bi разлагаются с образованием ароматич. металлоорг. соединений (р-ция Несмеянова).
Из р-ций присоединения А.с. наиб. важно каталитич. гидрирование - общий
метод синтеза соед. ряда циклогексана. А.с. присоединяют щелочные металлы;
образующиеся продукты, напр. нафтилид натрия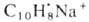 ,
представляют собой ионные пары катиона металла и анион-радикала А. с. При
действии донора протонов (обычно воды) они превращ. в дигидроароматич.
соединения. Последние прапаративно получают действием на А.с. Li или Na
в жидком NH3 в присут. алканола (р-ция Берна). Менее характерно
для А. с. циклоприсоединение. Так, термин. [2+ 4]-циклоприсоединение возможно
лишь для активир. А. с., напр. 1,2,4,5-тетраметилбензола (дурола) и нафталина,
с использованием активных диенофилов; в случае обычных диено-филов требуется
УФ-облучение. Последнее приводит к ди-меризации или изомеризации А.с.,
напр.:
,
представляют собой ионные пары катиона металла и анион-радикала А. с. При
действии донора протонов (обычно воды) они превращ. в дигидроароматич.
соединения. Последние прапаративно получают действием на А.с. Li или Na
в жидком NH3 в присут. алканола (р-ция Берна). Менее характерно
для А. с. циклоприсоединение. Так, термин. [2+ 4]-циклоприсоединение возможно
лишь для активир. А. с., напр. 1,2,4,5-тетраметилбензола (дурола) и нафталина,
с использованием активных диенофилов; в случае обычных диено-филов требуется
УФ-облучение. Последнее приводит к ди-меризации или изомеризации А.с.,
напр.:
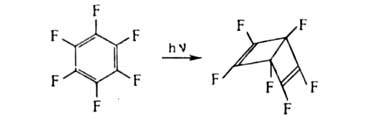
Жирноароматич. соед. обычно окисляются по атому С алкильной группы, соседнему с ароматич. кольцом, с сохранением бензольных колец. Таким способом получают ароматич. к-ты (напр., терефталевую из n-ксилола), альдегиды (n-нитробензальдегид из n-нитротолуола), кетоны (ацетофенон из этилбензола), спирты (трифенилкарбинол из трифенилметана). Большое практич. значение имеет превращ. алкилароматич. соед. в гидропероксиды, термич. разложение к-рых приводит к фенолам и алифатич. карбонильным соед., напр. синтез фенола и ацетона из гидропе-роксида кумола (р-ция Сергеева). Конденсир. ароматич. системы менее устойчивы к окислению, что используется, напр., в синтезе фталевой к-ты из нафталина.
Ароматич. углеводороды получают в пром-сти из продуктов коксования каменного угля и ароматизацией нефтяных углеводородов, а далее превращ. в разнообразные замещенные. В связи с уменьшением запасов нефти перспективной становится ароматизация алифатич. и алици-клич. углеводородов, получаемых при гидрировании каменного угля и на основе синтез-газа. Лаб. способы получения А.с. основаны на превращ. ароматич. углеводородов или др. доступных А. с.; в нек-рых случаях используют дегидрирование производных циклогексана, циклотримеризацию ацетиленов и ароматизацию аддуктов, образующихся по р-ции Дильса-Альдера. А.с.-важные промежут. и целевые продукты пром. орг. синтеза.
Лит.. Несмеянов А. Н„ Несмеянов Н. А., Начала органической химии,
кн. 2, М., 1970, с. 9-268; Эфрос Л. С, Горелик М. В., Химия и технология
промежуточных продуктов. Л., 1980; Хиней X., в кн.. Общая органическая
химия, пер. с англ.. т. 1. М., 1981, с. 314-455. Л. И. Беленький.


