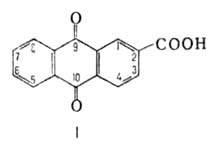
АНТРАХИНОНКАРБОНОВЫЕ КИСЛОТЫ. Практич. значение имеют
антрахинон-2-карбоновая к-та (2-А.; ф-ла I), ее замещенные-1-аминоантрахинон-2-
и 1-амино-4-бромантрахинон-2-карбоновые к-ты, а также используемая в лаб.
практике антрахинон-1-карбоновая к-та (1-А.). 1-А. и 2-А.-светло-желтые
кристаллы (см. табл.); плохо раств. в воде, раств. в уксусной кислоте,
ДМФА, конц. H2SO4; их Na-соли умеренно раств. в воде.
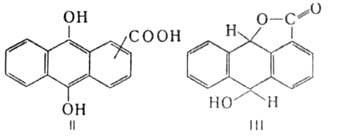
А. к. с РОС13, РС15 образуют хлорангидриды, к-рые при действии спиртов или аминов превращ. соотв. в эфиры или амиды. 1-А. и 2-А. восстанавливаются Zn в водном р-ре NH3 до антраценкарбоновых к-т, действием Na2S2O4 в р-ре NaOH - до 9,10-антрагидрохинонкарбоновых к-т (П). 1-А. под действием Sn в конц. НС1 восстанавливается до антрон-4-карбоновой к-ты и лактона 9,10-дигидро-9-антрол-1-карбоновой к-ты (III). Нитрование 1-А. в конц. H2SO4 при 95°С дает в осн. 5-нитроантрахинон-1-карбоновую к-ту. Сульфирование 2-А. 40%-ным олеумом при 100°С приводит к смеси 2-карбоксиантрахинон-6- и 1-А. способна к образованию гетероциклич. соединений антрона, напр. с гидразингидратом-пиридазонантрона (IV), с гидроксиламином - оксазонантрона (V). 2-А. при2-карбоксиантрахинон-7-сульфокислот. нагр. с NaOH до 280-300°С декарбоксилируется до антрахинона. В 1-амино-4-бромантрахинон-2-карбоновой к-те при взаимод. с аминами в присут. соединений Сu атом брома замещается на остаток амина и образуются продукты, используемые как кислотные красители. Хлорангидрид 1-аминоантрахинон-2-карбоновой к-ты конденсируется по р-ции Фриделя - Крафтса с бензолом, образуя 1-амино-2-бензоилантрахинон-промежут. продукт в синтезе дисперсных красителей. Хлорангидрид 2-А. применяют в произ-ве кубовых красителей.
СВОЙСТВА АНТРАХИНОНКАРБОНОВЫХ КИСЛОТ
|
Заместители и их положение в ядре антрахинона
|
Мол. м.
|
Т.пл., °С
|
 , нм
, нм |
|
1-СООН
|
252,21
|
294
|
329
|
|
2-СООН
|
252,21
|
292
|
324
|
|
1-NН2, 2-СООН
|
267,23
|
286
|
486
|
|
I-NH2, 2-СООН, 4-Вг
|
346,14
|
325
|
506
|
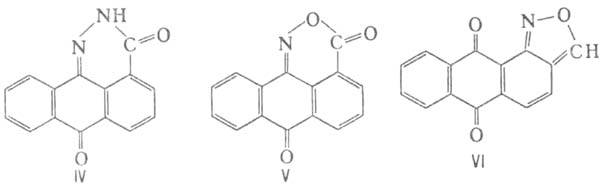
Получают 1-А. окислением бензантрона в разб. H2SO4 при 70°С действием СrО3; окислением 1-метилантрахинона разб. HNO3 при 160°С под давлением; диазотированием 1-аминоантрахинона с послед. заменой диазогруппы на CN-группу и омылением ее в р-ре H2SO4; циклизацией 3-бензоилфталевой или 2-бензоилизофталевой к-ты. 2-А. синтезируют окислением 2-метилантрахинона действием СгО3 в СН3СООН или циклизацией бензофенон-2,4'-дикарбоновой к-ты в 5%-ном олеуме при 110-120°С 1-Аминоантрахинон-2-карбоновую к-ту получают внутримолекулярным превращ. 1-нитро-2-метилантрахинона в 60%-ном олеуме с образованием антра[1,2-с]изоксазол-6,11-диона (VI) с послед. его щелочным гидролизом. Бромированием 1-аминоантрахинон-2-карбоновой к-ты в конц. H2SO4 при 90°С синтезируют 1-амино-4-бромантрахинон-2-карбоновую к-ту.
Лит.: Горелик М. В., Химия антрахинонов и их производных, М.,
1983. С. И. Попов.


