АНТРАХИНОН (от греч. anthrax - уголь и kina, на языке индейцев
кечуа - кора хинного дерева), мол. м. 208,20; светло-желтые кристаллы;
т. пл. 287°С, т. кип. 377°С (с возг.); d420 1,438;
Сp° 265 Дж/(моль*К); Н°пл
32,57
Дж/моль,
Н°пл
32,57
Дж/моль, Нообр
— 179 Дж/моль; хорошо раств. в большинстве орг. р-рителей при нагр., напр.
в этаноле -5% (18°С), 22,5% (78 °С), толуоле1,9% (15°C), 25,6% (100°С),
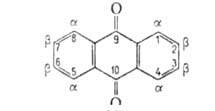
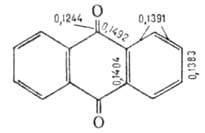
практически не раств. в воде (0,006% при 50°С). Молекула А. - плоская,
валентные углы близки 120°, длины связей (в нм) см. на рис.
Нообр
— 179 Дж/моль; хорошо раств. в большинстве орг. р-рителей при нагр., напр.
в этаноле -5% (18°С), 22,5% (78 °С), толуоле1,9% (15°C), 25,6% (100°С),
практически не раств. в воде (0,006% при 50°С). Молекула А. - плоская,
валентные углы близки 120°, длины связей (в нм) см. на рис.
Кристаллич. решетка моноклинная (а = 1,5810 нм, b = 0,3942 нм,
с = = 0,7865 нм, =102,43°, пространств. группа Р21/а). В УФ-спектре
=102,43°, пространств. группа Р21/а). В УФ-спектре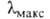 251, 279, 321 и 377 нм (
251, 279, 321 и 377 нм (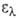 54*103, 17,6*103, 4,8*103 и 110 соотв.);
в ИК-спектре полоса поглощения при частоте А. обратимо переходит
54*103, 17,6*103, 4,8*103 и 110 соотв.);
в ИК-спектре полоса поглощения при частоте А. обратимо переходит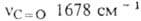 в 9,10-дигидроксиантрацен (антрагидрохинон) при восстановлении действием
Na2S2O4 в щелочной среде, NaBH4
или Н2 в присут. катализатора. Более глубокое восстановление
(напр., А1 в H2SO4) приводит к антрону и затем -
к антрацену. При одноврем. действии восстановителя и ацилирующего или алкилирующего
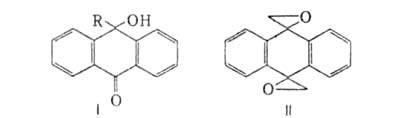
агента получают эфиры антрагидрохинона. А. присоединяет RMgHal или RLi
к одной (ф-ла I, R-Alk или Аr) либо к обеим карбонильным группам. При обработке
ДМСО в присут. NaH из А. образуется соед. ф-лы I, где R=CH2SO2CH3,
а при послед. действии КОН в ДМСО-10-гидрокси-9-формилантрацен. При р-ции
с диметилсульфонийметилидом (CH3)2S=СН2
образуется производное с одним или двумя (ф-ла II) оксирановыми циклами.
Из соед. II при восстановлении получают 9,10-диметилантрацен, при действии
ВF3-9,10-диформилантрацен. А. с трудом реагирует с гидроксиламином,
давая монои диоксимы. Не взаимод. с гидразинами. При действии аналина и
А1С13 превращ. в 9,10-бис-(фениламин).
в 9,10-дигидроксиантрацен (антрагидрохинон) при восстановлении действием
Na2S2O4 в щелочной среде, NaBH4
или Н2 в присут. катализатора. Более глубокое восстановление
(напр., А1 в H2SO4) приводит к антрону и затем -
к антрацену. При одноврем. действии восстановителя и ацилирующего или алкилирующего
агента получают эфиры антрагидрохинона. А. присоединяет RMgHal или RLi
к одной (ф-ла I, R-Alk или Аr) либо к обеим карбонильным группам. При обработке
ДМСО в присут. NaH из А. образуется соед. ф-лы I, где R=CH2SO2CH3,
а при послед. действии КОН в ДМСО-10-гидрокси-9-формилантрацен. При р-ции
с диметилсульфонийметилидом (CH3)2S=СН2
образуется производное с одним или двумя (ф-ла II) оксирановыми циклами.
Из соед. II при восстановлении получают 9,10-диметилантрацен, при действии
ВF3-9,10-диформилантрацен. А. с трудом реагирует с гидроксиламином,
давая монои диоксимы. Не взаимод. с гидразинами. При действии аналина и
А1С13 превращ. в 9,10-бис-(фениламин).
А. сульфируется 20-40%-ным олеумом: в отсутствие катализатора с образованием последовательно антрахинон-2-сульфокислоты и затем смеси 2,6- и 2,7-дисульфокислот, а в присут. солей Hg(II)-прреим. с образованием антрахинон-1-сульфокислоты и затем смеси 1,5- и 1,8-дисульфокислот. Т.к. наличие сульфогруппы мало замедляет сульфирование в др. кольцо, получение моносульфокислот ведут до конверсии А. не более 50%. При нитровании азотной к-той образуется 1-нитроантрахинон с примесью 2-нитроантрахинона, а затем смесь 1,5-, 1,8-динитроантрахинонов (ок. 75%) и 1,6-, 1,7-динитроантрахинонов (ок. 20%). А. хлорируется газообразным С12 в H2SO4 или олеуме в присут. I2, превращаясь в осн. в 1,4,5,8-тетрахлорантрахинон.
В пром-сти А. получают:
1. Окислением очищенного антрацена (концентрация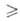 93%) воздухом при 360-380 °С на катализаторах, содержащих V2O5,
действием Na2Cr2O7 в 48%-ной H2SO4
или HNO3 в орг. р-рителе (уксусной к-те, нитробензоле, трихлорбензоле),
а также окислением сырого антрацена (концентрация 20-30%), к-рый сначала
гидрируют в 9,10-дигидроантрацен и затем окисляют кислородом или HNO3
в орг. р-рителе.
93%) воздухом при 360-380 °С на катализаторах, содержащих V2O5,
действием Na2Cr2O7 в 48%-ной H2SO4
или HNO3 в орг. р-рителе (уксусной к-те, нитробензоле, трихлорбензоле),
а также окислением сырого антрацена (концентрация 20-30%), к-рый сначала
гидрируют в 9,10-дигидроантрацен и затем окисляют кислородом или HNO3
в орг. р-рителе.
2. Взаимод. фталевого ангидрида с бензолом в присут. А1С13 в избытке бензола или при размоле в шаровой мельнице без р-рителя. После обработки массы разб. H2SO4 образовавшуюся 2-бензоилбензойную к-ту циклизуют в А. нагреванием в концентрированной H2SO4 или олеуме при 110-150°С.
3. Диеновым синтезом из смеси продуктов окисления нафталина, содержащей 1,4-нафтохинон, и 1,3-бутадиена с послед. окислением полученного 1,4,4а,9а-тетрагидроантрахинона воздухом. Возможен синтез из 1,4-бензохинона и бутадиена (молярное соотношение 1:2).
4. Димеризацией стирола в присут. Н3РО4 в 1-метил-3-фенилиндан с послед, окислением в А. воздухом на ванадиевом кат. или в 2-бензоилбензойную к-ту (HNO3, воздухом в уксусной к-те в присут. Со ) и ее циклизацией.
А. применяют для произ-ва антрахиноновых красителей, полициклич. кубовых красителей, бензантрона и др. Мировое произ-во А. ок. 35 тыс. т/год (1980), большую часть получают окислением антрацена. А. впервые синтезирован О. Лораном в 1835 окислением антрацена азотной к-той.
Лит.: Горелик М. В., Химия антрахинонов и их производных, М.,
1983; Ullmann's Encyclopedic, 4 Aufl., Bd 7, Weinheim, 1974, S. 579; Methoden
der organischen Chemie (Houben-Weyl), 4 Aufl., Bd 7/3c, Stuttg., 1979.
М. В. Горелик.


