АНРИ РЕАКЦИИ. 1. Получение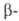 нитроспиртов
присоединением первичных или вторичных нитроалканов к карбонильным соед.,
обычно в присут. оснований, напр.:
нитроспиртов
присоединением первичных или вторичных нитроалканов к карбонильным соед.,
обычно в присут. оснований, напр.:
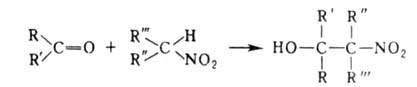
При использовании первичных нитроалканов образующиеся нитроспирты могут снова вступать в А. р. При этом из нитрометана возможен синтез трехатомных спиртов, из др. первичных нитроалканов-двухатомных. Реакц. способность вторичных нитроалканов ниже, чем первичных.
Использование дикарбонильных соед. позволяет осуществлять циклизацию,
напр.:
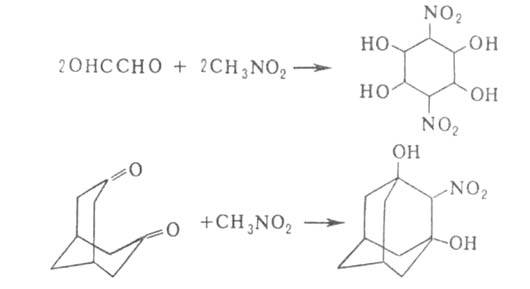
В сочетании с р-цией Нефа (синтез карбонильных соед. из нитросоединений)
А. р. применяют для удлинения углеродной цепи на 1-2 звена при получении
углеводов (т. наз. р-ция Соудена-Фишера):
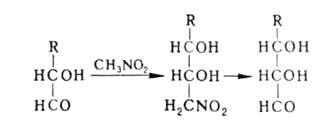
Побочные процессы при А. р.-дегидратация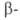 нитроспиртов
(особенно при использовании кетонов и жирноароматич. альдегидов), а также
р-ция Нефа (при выделении конечного продукта).
нитроспиртов
(особенно при использовании кетонов и жирноароматич. альдегидов), а также
р-ция Нефа (при выделении конечного продукта).
В р-цию, подобную А. р., вступают нитроолефины, не содержащие двойной
связи в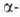 положении,
с гидросульфитными производными альдегидов RCH(OH)SO3Na (т.
наз. р-ция Камле). Р-ция открыта Л. Анри в 1895.
положении,
с гидросульфитными производными альдегидов RCH(OH)SO3Na (т.
наз. р-ция Камле). Р-ция открыта Л. Анри в 1895.
Лит.: Химия нитро- и нитрозогрупп, пер. с англ., т. 2, М., 1973, с. 63-65; Химия алифатических и алициклических нитросоединений, М., 1974, с. 62-73; Summers L., "Chem. Revs.", 1955, v. 55, № 2, p. 301-53.
2. Синтез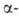 галогенэфиров
действием галогеноводорода на смесь эквимолекулярных кол-в альдегида и
первичного или вторичного спирта при т-рах от — 5 до О °С:
галогенэфиров
действием галогеноводорода на смесь эквимолекулярных кол-в альдегида и
первичного или вторичного спирта при т-рах от — 5 до О °С:
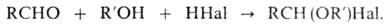
Выход р-ции (70-100%) возрастает с увеличением длины углеродной цепи альдегида и при применении водоотнимающих ср-в (напр., Na2SO4, СаС12). Вместо галогеноводорода м.б. использованы РС15, SOC12 и т.п. Побочные продукты-алкилгалогениды, виниловые эфиры и ацетали. Р-ция открыта Л. Анри в 1893.
Лит.. Поконова Ю. В., Химия и технология галогенэфиров. Л., 1982. Д. И. Махонькое.


