АММОНИЯ СУЛЬФАТ (NH4)2SO4, бесцв.
кристаллы с ор-торомбич. решеткой (а = 0,7782 нм, b = 5993
нм, с — = 1,0636 нм, z = 4, пространств, группа Ршгш); плотн. 1,766
г/см3; Сp° 187,4 ДжДмоль-К); Нообр
-1180,26 кДж/моль,
Нообр
-1180,26 кДж/моль,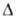 Gообр
-901,35 кДж/моль; S°298 220,1 Дж/ (моль*К). Выше 100оС
разлагается с выделением NH3 и образованием сначала NH4HSO4,
а затем (NH4)2S2O7 и сульфаниловой
к-ты. Р-римость в воде (г в 100 г): 70,5 (0оС), 76,4 (25°С),
101,7 (100°С). Окисляется до N2 под действием сильных окислителей,
напр. КМпО4. Образует двойные соли с сульфатами др. металлов,
напр. Al, Fe. А.с. получают: поглощением серной к-той NH3, содержащегося
в коксовом газе (осн. метод); нейтрализацией H2SO4
синтетич. NH3; взаимод. CaSO4 или Na2SO4
с (NH4)2CO3 или смесью NH3
с СО2; как побочный продукт в произ-ве капролактама, при очистке
топочных газов от SO2 р-рами NH3. А.с. в осн. используют
как удобрение. Его также применяют как компонент осадительной ванны при
формовании вискозного волокна, в кач-ве добавки к стекольной шихте (для
улучшения ее плавкости).
Gообр
-901,35 кДж/моль; S°298 220,1 Дж/ (моль*К). Выше 100оС
разлагается с выделением NH3 и образованием сначала NH4HSO4,
а затем (NH4)2S2O7 и сульфаниловой
к-ты. Р-римость в воде (г в 100 г): 70,5 (0оС), 76,4 (25°С),
101,7 (100°С). Окисляется до N2 под действием сильных окислителей,
напр. КМпО4. Образует двойные соли с сульфатами др. металлов,
напр. Al, Fe. А.с. получают: поглощением серной к-той NH3, содержащегося
в коксовом газе (осн. метод); нейтрализацией H2SO4
синтетич. NH3; взаимод. CaSO4 или Na2SO4
с (NH4)2CO3 или смесью NH3
с СО2; как побочный продукт в произ-ве капролактама, при очистке
топочных газов от SO2 р-рами NH3. А.с. в осн. используют
как удобрение. Его также применяют как компонент осадительной ванны при
формовании вискозного волокна, в кач-ве добавки к стекольной шихте (для
улучшения ее плавкости).
При нагр. А.с. до 147°С получают гидросульфат NH4HSO4
-
бесцв. кристаллы с моноклинной решеткой (эта модификация устойчива выше
— 3,5°С; а = 2,4701 нм, b = = 0,4501 нм, с = 1,4829нм,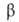 =90°,
z=16, пространств, группа P21/a); т. пл. 146,7°С; плотн.
1,78 г/см3;
=90°,
z=16, пространств, группа P21/a); т. пл. 146,7°С; плотн.
1,78 г/см3;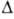 Нообр
- 1025,5 кДж/моль. Выше 147°С разлагается с образованием NH3
и (NH4)2S2O7. Раств. в воде.
п.м. чукуров.
Нообр
- 1025,5 кДж/моль. Выше 147°С разлагается с образованием NH3
и (NH4)2S2O7. Раств. в воде.
п.м. чукуров.


