СВОЙСТВА МОНОАМИНОПИРИДИНОВ
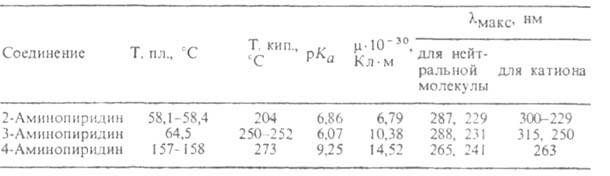
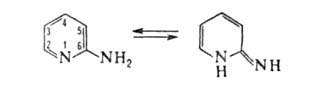
2- и 4-А. способны к таутомерному превращению соотв. в 2- и 4-пиридонимины,
однако в обычных условиях существуют практически в аминной форме, напр.:
Моноаминопиридины обладают мн. св-вами первичных аминов. При взаимод. 2-А. с алкилирующими агентами (алкилгалогенидами, алкилсульфатами или диазометаном) алкилируется в первую очередь кольцевой атом N. В присут. NaNH2 образуется 2-алкиламинопиридин. Дальнейшим алкилированием получают диалкиламинопиридины.
Существ. различие в хим. св-вах изомерных моноаминопиридинов проявляется
в их р-циях с HNO2: 3-А. диазотируется с образованием солей
диазония, 2- и 4-А. образуют в слабокислом р-ре гидроксипиридины (пиридоны),
а в присут. конц. соляной к-ты - хлорпиридины. Соли диазосоединений из
2-А. получают по р-ции:
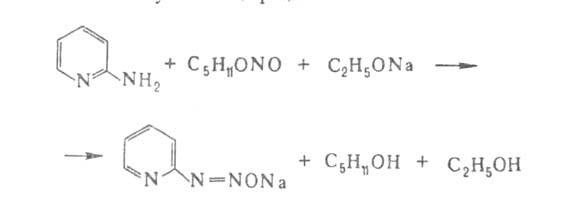
Моноаминопиридины реагируют с сильными электрофилами, восстанавливаются
в производные пиперидина. Аминогруппа компенсирует дезактивирующий эффект
атома N пиридина и ориентирует замещение в кольце. Если аминогруппа находится
в положении 2, 3 или 4, то электроф. замещение происходит соотв. в положения
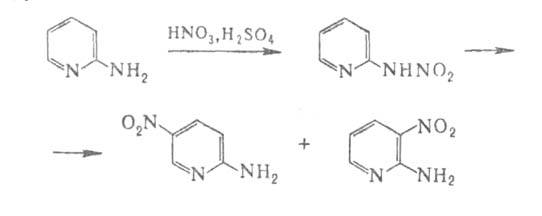
5, 2 или 3 (5). При действии на 2-А. нитрующей смеси образуется нитрамин,
к-рый в присут. H2SO4 изомеризуется в смесь 5-нитро-
и З-нитро-2-аминопиридинов с выходами соотв. 80 и 10%:
2-А. получают аминированием пиридина амидом натрия по р-ции Чичибабина, 3-А.-обработкой никотинамида гипобромитом по р-ции Гофмана или аммонолизом 3-бромпиридина в присут. CuSO4, 4-А. - оглавлением 4-феноксипиридина с NH4C1, аммонолизом 4-хлорпиридина в присут. ZnCl2 или взаимод. изоникотинамида с гипобромитом по р-ции Гофмана. Моноаминопиридины применяют для получения лек. ср-в и красителей.
Известны все 6 изомеров диаминопиридина и 6 изомеров триаминопиридина. По способам получения и хим. св-вам эти соед. аналогичны моноаминопиридинам.
Продукт азосочетания 2,6-диаминопиридина с диазотированным 5-амино-2-бутоксипиридином (неотропин) обладает бактерицидными св-вами. 2,3,6-Триаминопиридин - проявитель в фотографии, 2,3- и 2,6-диаминопиридины - реагенты для фотометрич. определения соотв. Rh и первичных аминов.
Лит.: Мошер Г., в кн.: Гетероциклические соединения, под ред.
Р. Эльдерфилда, пер. с англ., т. 1, М., 1953. с. 424-34; Schofield К.,
Hetero-aromatic nitrogen compounds. Pyrroles and pyridines, L., 1967; Giam
С S., в кн,: Chemistry of heterocyclic compounds, v. 14, N.Y.-L., 1974,
Suppl. pt 3. P. С. Сагитуллин.


