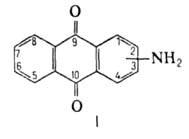
АМИНОАНТРАХИНОНЫ. Практич. значение
имеют 1-амино- и 2-аминоантрахиноны (1-А. и 2-А., ф-ла I), а также N- и 2-алкилзамещенные
1-аминоантрахинона и диаминоантрахиноны. А.-кристаллы (см. табл.) от
оранжевого до темно-красного цвета; не раств. в воде, плохо раств. в спирте,
раств. в уксусной к-те, ДМФА, хлороформе, конц. H2SO4.
Из-за акцепторного влияния антрахинонового ядра А.-более слабые основания, чем
др. ароматич. амины. Для 1-А. и его N-монозамещенных характерно наличие сильной
внутримолекулярной водородной связи между водородом аминогруппы и кислородом
карбонильной. Эта связь-причина пониженной основности 1-А. по сравнению с 2-А.
СВОЙСТВА АМИНОАНТРАХИНОНОВ
|
Заместитель и его положение в ядре антрахинона
|
Мол. м.
|
Т. пл., °С
|
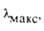 нм
нм |
рКа
|
|
1-Амино
|
. 223,22
|
253
|
475
|
1,0
|
|
2-Амино
|
. 223,22
|
302
|
455
|
1,3
|
|
1-Метиламино
|
. 237,25
|
170
|
510
|
1,4
|
|
1-Амино-2-метил
|
. 237,25
|
205
|
480
|
—
|
В зависимости от условий А. восстанавливаются до аминозамещенных антрацена или 9,10-антрагидрохинона, напр. 1-А. и 2-А. под действием Zn в водном р-ре NH3 или Na2S2O4 в водно-щелочном р-ре превращаются соотв. в 1-или 2-амино-9,10-антрагидрохинон, а 2-А. под действием красного фосфора в среде HI - в 2-аминоантрацен.
1-А. и 2-А. диазотируются в конц. H2SO4 с образованием соответствующих сульфатов диазония. При галогенировании 1-А. последовательно превращается в 1-амино-2-галоген- и 1-амино-2,4-дигалогенантрахиноны - промежут. продукты в синтезе антрахиноновых красителей. Бромирование 1-метиламиноантрахинона в разб. H2SO4 приводит к 1-метиламино-4-бромантрахинону - промежут. продукту в синтезе дисперсных и катионных красителей, З-метил-6-бромантрапиридона и красителей на его основе. 2-А. при хлорировании газообразным С12 в СН3СООН образует 1,3-дихлор-2-аминоантрахинон, а при бромировании в нитробензоле или СН3СООН-3-бром-2-аминоантрахинон. 1-Амино-2-метилантрахинон с Вr2 в разб. H2SO4 образует 1-амино-2-метил-4-бромантрахинон. При нитровании 1-А. или 1-метиламиноантрахинона в конц. H2SO4 получают смесь 2- и 4-нитрозамещенных.
Важная р-ция 1-А. - сульфирование хлорсульфоновой к-той в нитробензоле
при 100-120°С или в избытке олеума с образованием 1-аминоантрахинон-2-сульфокислоты
- промежут. продукта в синтезе 1-амино-4-бромантрахинон-2-сульфокислоты
(бромаминовой к-ты).
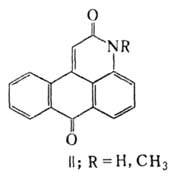
При кипячении 1-А. в уксусном ангидриде в присут. СН3СООК образуется антрапиридон (ф-ла II; R = Н). Ацетилирование 1-метиламиноантрахинона с послед. циклизацией в водной щелочи приводит к 1-метилантрапиридону (ф-ла II; R = СН3).
В пром-сти 1-А. и 1-метиламиноантрахинон получают аммонолизом К-соли антрахинон-1-сульфокислоты в автоклаве в 25-30%-ных водных р-рах соотв. NH3 (при 180°С) или метиламина (при 120-150°С). Р-ции проводят в присут. м-нитробензолсульфокислоты для окисления отщепляющегося сульфит-иона. Аналогично получают и 2-А. из Na-соли антрахинон-2-сульфокислоты, но чаще для синтеза более чистого продукта с большим выходом используют аммонолиз 2-хлорантрахинона при 205 °С и давл. 4,5 МПа в присутствии CuSO4. 1-А. получают также восстановлением достаточно чистого 1-нитроантрахинона кипячением в водном р-ре Na2S. Лаб. способ-взаимод. 1-хлорантрахинона с n-толуолсульфамидом в амиловом спирте в присут. (СН3СОО)2Си с послед. гидролизом сульфамидной группы в конц. H2SO4.
1-Амино-2-метилантрахинон в пром-сти получают восстановлением 1-нитро-2-метилантрахинона Na2S, в лаборатории - обработкой 1-А. 2 молями Na2S2O4 в щелочном р-ре в атмосфере азота с послед. добавлением 2 молей формальдегида при 60 °С и дальнейшем окислении воздухом (р-ция Маршалка).
1-А. используют также для получения антримидов, фталоилкарбазолов и кубовых красителей. 2-А. - исходный продукт для получения кубового красителя индантрона, антримидов. 1-Амино-2-метилантрахинон-дисперсный оранжевый краситель; используется также в синтезе красителей более сложного строения.
Лит.: Ворожцов Н.Н., Основы синтеза промежуточных продуктов и
красителей, 4 изд., М., 1955; Эфрос Л. С, Горелик М. В., Химия и технология
промежуточных продуктов, Л., 1980. С. И. Попов.


