АМЕРИЦИЙ (от Америка, по месту открытия; лат. Americium) Am,
искусств. радиоактивный хим. элемент III гр. периодич. системы; ат.н. 95;
относится к актиноидам. Стабильных изотопов не имеет. Получены 13
изотопов с мас.ч. 237-246, в т.ч. ядерные изомеры изотопов 242Ат
и 244Ат. Наиб. долгоживущие изотопы 241Ат(Т1/2
432 года) и 243Ат(Т1/2 7370 лет) -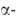 излучатели
излучатели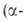 излучение
сопровождается
излучение
сопровождается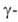 излучением).
Конфигурация внеш. электронных оболочек атома 5f6s26p67s2;
степень окисления от +2 до +7 (наиболее характерна +3); энергия ионизации
Am° -> Am+ 6,0 эВ; электроотрицательность по Полингу 1,0-1,2;
атомный радиус 0,174нм; ионные радиусы Ат3+, Ат4+,
Ат5+ и Ат6+ соотв. 0,0962, 0,0888, 0,0860 и 0,0800
нм.
излучением).
Конфигурация внеш. электронных оболочек атома 5f6s26p67s2;
степень окисления от +2 до +7 (наиболее характерна +3); энергия ионизации
Am° -> Am+ 6,0 эВ; электроотрицательность по Полингу 1,0-1,2;
атомный радиус 0,174нм; ионные радиусы Ат3+, Ат4+,
Ат5+ и Ат6+ соотв. 0,0962, 0,0888, 0,0860 и 0,0800
нм.
А. - серебристо-белый металл, светящийся в темноте под действием собственного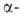 излучения.
При обычной т-ре и давлении меньше 5 ГПа устойчива модификация с двойной
гексаген, решеткой типа
излучения.
При обычной т-ре и давлении меньше 5 ГПа устойчива модификация с двойной
гексаген, решеткой типа La
(а = 0,3468 нм, с = = 1,1241 нм, z = 4, пространств. группа
R63/mmc). Выше 600°С устойчива модификация с кубич. гранецентриров.
решеткой (а = 0,4894 нм). При давл. 11-14 ГПа и нормальной т-ре
получены две др. модификации. Т. пл. 1173°С, т. кип. 2607°С; рентгеноструктурная
плотн. 13,67 г/см3 (20 °С); Сp° 25,85 Дж/(моль*К);
La
(а = 0,3468 нм, с = = 1,1241 нм, z = 4, пространств. группа
R63/mmc). Выше 600°С устойчива модификация с кубич. гранецентриров.
решеткой (а = 0,4894 нм). При давл. 11-14 ГПа и нормальной т-ре
получены две др. модификации. Т. пл. 1173°С, т. кип. 2607°С; рентгеноструктурная
плотн. 13,67 г/см3 (20 °С); Сp° 25,85 Дж/(моль*К); Н0пл
1437 кДж/моль; S0298 54,84 Дж/(моль*К); ур-ние
температурной зависимости давления пара в интервале т-р 830-1180°С: Igp(Ha)
= 13,7319 - 16961 /Т - l,2381gT.
Н0пл
1437 кДж/моль; S0298 54,84 Дж/(моль*К); ур-ние
температурной зависимости давления пара в интервале т-р 830-1180°С: Igp(Ha)
= 13,7319 - 16961 /Т - l,2381gT.
По хим. св-вам А. во многом подобен лантаноидам. Окисляется кислородом, давая при его недостатке оксид АтО. Взаимод. с разб. к-тами, образуя соли Am3+. Энергично реагирует с газообразным Н2 уже при 50°С, давая гидрид AmH2,7±0,3; известны также дигидрид АmН2 и тригидрид АтН3.
При прокаливании на воздухе Am(NO3)3, Am(OH)3 или Ат2(С2О4)3 образуется диоксид АтО2 - черные кристаллы с кубич. решеткой. При восстановлении диоксида водородом получают сесквиоксид Ат2О3 - коричневые кристаллы; при 600°С образуется модификация Ат2О3 с кубич. решеткой (а = 0,1103 нм), при 800°С - с гексагональной (а = 0,3817 нм, с = 0,5971 нм). Существует непрерывный ряд нестехиометрич. оксидов состава от АтО2-х до AmO1,5+х. Известен гидроксид Ат(ОН)3, а также Ат(ОН)4, получаемый при действии Н2О2 на соли Am3+ в водных р-рах NH3 либо окислением Ат(ОН)3 гипохлоритом Na или Н2О2 в щелочной среде. При взаимод. АтО2 со смесью H2S и CS2 при 1400-1500°С образуется сесквисульфид Am2S3.
С галогенами А. дает тригалогениды; известны также AmF4, AmF5 и AmF6. Трифторид AmF3 - розовые кристаллы с гексаген. решеткой типа LaF3 (а = 0,4067 нм, с = 0,7225 нм); т. пл. 1393°С; плохо раств. в воде и орг. р-рителях; получают действием газообразного HF на АтО2 при 150°С или осаждением фтористоводородной к-той из водного р-ра солей А. в виде гидрата с послед. обезвоживанием при 85 °С. Тетрафторид AmF4 - коричневые кристаллы с моноклинной решеткой типа UF4 (а = 0,1249. нм, b = 0,1047 нм, с = 0,8190 нм); выше 635 °С разлагается до AmF3; получают фторированием AmF3 или АтО2 элементным фтором при 400-500°С. Трихлорид АтС13- розовые кристаллы с гексаген. решеткой (а = — 0,738 нм, с = 0,425 нм); получают взаимод. АтО2 с СС14 при 800°С или с НС1 при 250-300°С. Трибромид AmBr3 (белые кристаллы) и трииодид AmI3 (желтые кристаллы) получают взаимод. АтО2 соотв. с А1Вr3 или АlI3 при 500°С.
Известны также оксигалогениды AmOCl и AmO2F2, а также комплексные фториды Rb[AmF6] и (NH4)4[AmF8].
К соед. Am(III) относятся также арсенат AmAsO4, вана-дат AmVO4, ниобат AmNbO4, фосфат АтРО4*0,5Н2О, перксенат Ат4ХеО6*40Н2О и др. Выделены кристаллич. соед. Am(V)-RbAmO2CO3, NH4AmO2CO3 и K5[AmO2(CO3)3]. Кристаллич. соединения Ат(VI)-америцилацетат NaAmO2(C2H3O2)3, америцилаты Li4AmO5 и Li6AmO6.
Формальные окислит, потенциалы А. (в В) в кислом р-ре:
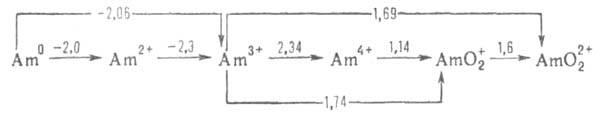
Для ионов Am3+, Ат4+ , АтО+2
и АтО2+ Н0обр
оценивается соотв. -616,7, -406,0, -805,0, -651,9 кДж/моль. Разб. водные
р-ры Am(III) имеют розовую окраску, концентрированные - желтую. В кислых
р-рах соед. Am(III) образуется ион Am(VI), а не Am(V). В конц. р-рах фторидов
щелочных металлов, а также в присут. Н3РО4, Na4P2O7
или ненасыщ. гетерополианионов устойчив Am(IV). Неустойчивость Am(IV) обусловлена
его диспропорционированием, самовосстановлением вследствие
Н0обр
оценивается соотв. -616,7, -406,0, -805,0, -651,9 кДж/моль. Разб. водные
р-ры Am(III) имеют розовую окраску, концентрированные - желтую. В кислых
р-рах соед. Am(III) образуется ион Am(VI), а не Am(V). В конц. р-рах фторидов
щелочных металлов, а также в присут. Н3РО4, Na4P2O7
или ненасыщ. гетерополианионов устойчив Am(IV). Неустойчивость Am(IV) обусловлена
его диспропорционированием, самовосстановлением вследствие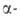 радиолиза
р-ров, а также восстановлением водой до Am(III).
радиолиза
р-ров, а также восстановлением водой до Am(III).
Am(V) образуется при окислении Am(III) в р-ре К2СО3
гипохлоритом или пероксодисульфатом Na, О3, а также при
восстановлении Am(VI) ионами Cl- , Br-, NO-2
или Н2О2. В кислой среде Am(V) существует в виде
иона AmO+2; Am(V) диспропорционирует в конц. р-рах
минеральных к-т с образованием Am(III) и Am(VI), медленно восстанавливается
Н2О2, I- и др. до Am(III). Под действием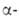 излучения
241Аm происходит самовосстановление Am(V) до Am(III). Ион Am(VI)
образуется при окислении Am(III) озоном в р-ре NaHCO3 или щелочи,
ионами S2O82 или Ag2+ в слабокислой
среде либо в р-рах карбонатов щелочных металлов, при анодном окислении
Am(III), а также при окислении Am(V) в горячих разб. р-рах НС1О4
или HNO3 действием О3, Се4+ или Ag2+.
В кислых р-рах Am(VI) присутствует в виде иона америцила АтО22+
. Р-ры Am(VI) светло-желтые в 1 М НС1О4, светло-коричневые в
1 М HNO3, желто-зеленые в 1 М HF, красно-коричневые в 1 М H2SO4.
Ионы АтО22+ -сильные окислители, восстанавливаются
N2H4, NH2OH, Н2О2
или I до Ат3+ . Под действием
излучения
241Аm происходит самовосстановление Am(V) до Am(III). Ион Am(VI)
образуется при окислении Am(III) озоном в р-ре NaHCO3 или щелочи,
ионами S2O82 или Ag2+ в слабокислой
среде либо в р-рах карбонатов щелочных металлов, при анодном окислении
Am(III), а также при окислении Am(V) в горячих разб. р-рах НС1О4
или HNO3 действием О3, Се4+ или Ag2+.
В кислых р-рах Am(VI) присутствует в виде иона америцила АтО22+
. Р-ры Am(VI) светло-желтые в 1 М НС1О4, светло-коричневые в
1 М HNO3, желто-зеленые в 1 М HF, красно-коричневые в 1 М H2SO4.
Ионы АтО22+ -сильные окислители, восстанавливаются
N2H4, NH2OH, Н2О2
или I до Ат3+ . Под действием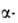 излучения
241Аm происходит самовосстановление Am(VI) до Am(V).
излучения
241Аm происходит самовосстановление Am(VI) до Am(V).
С металлич. Ри А. образует непрерывный ряд твердых р-ров в интервале концентраций А. 6-80% по массе.
Изотоп 241Аm образуется в результате ядерных р-ций:
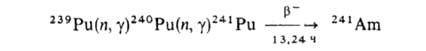
Он м. б. выделен также из отработанного ядерного топлива после его хранения
в течение неск. лет (в США ежегодно извлекают ок. 4 кг). Изотоп 243Аm
получают по ядерным р-циям:
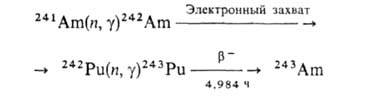
Извлекают А. с помощью ионного обмена с использованием в кач-ве элюентов р-ров NH4CNS или конц. НС1, а также экстракцией трибутилфосфатом, третичными аминами и др.
Металлич. А. получают восстановлением его фторидов или диоксида: AmF4 - кальцием при 1500-1600°С в бомбе или тигле из MgO; AmF3- парами Ва в танталовом тигле при 1100-1200°С в глубоком вакууме; АmО2 - лантаном при 1500°С или торием при 1550°С.
Изотоп 241Am - исходное в-во для получения в ядерных реакторах трансурановых элементов с высшими атомными номерами. Смесь 241Аm с 9Ве- источник нейтронов в дефектоскопии.
А. высокотоксичен; ПДК для 241Аm и 243Аm в открытых водоемах соотв. 70,3 и 81,4 Бк/л, в воздухе -1,1*10-4 и 1,0*10-4 Бк/л. А. синтезирован и идентифицирован в 1944 Г. Сиборгом, Л. Морганом, Р. Джеймсом и А. Гиорсо.
Лит. см. при ст. Актиноиды. Б. В. Громов.


