АЛАНИН, мол. м. 89,09.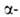 Алании
(
Алании
(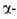 аминопропионовая
к-та, Ala), A)CH3CH(NH2)COOH-кристаллы; т.пл. D,
L-A. 295-296 °С, L-А.- 315-316 °С, D-А.- 291 -293 °С (плавятся с разл.);
для L-A.
аминопропионовая
к-та, Ala), A)CH3CH(NH2)COOH-кристаллы; т.пл. D,
L-A. 295-296 °С, L-А.- 315-316 °С, D-А.- 291 -293 °С (плавятся с разл.);
для L-A.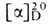 14,2° (концентрация 10 г в 100 мл 6 н. НС1); раств. в воде, плохо-в этаноле,
не раств. в эфире. Для L-A. рХа СООН и NH2 соотв.
2,34 и 9,6, рI-6,0.
14,2° (концентрация 10 г в 100 мл 6 н. НС1); раств. в воде, плохо-в этаноле,
не раств. в эфире. Для L-A. рХа СООН и NH2 соотв.
2,34 и 9,6, рI-6,0.
По хим. св-вам А.-типичная алифатич. аминокислота.
L-A.-кодируемая
аминокислота, встречается во всех организмах в своб. виде и в составе белков.
D-A. обнаружен только в бактериях и в опиоидных пептидах, выделенных из
кожи южноамериканских лягушек. Биосинтез L-A. происходит в результате аминирования
и переаминирования пировиноградной к-ты или
аминокислота.
L-A.-кодируемая
аминокислота, встречается во всех организмах в своб. виде и в составе белков.
D-A. обнаружен только в бактериях и в опиоидных пептидах, выделенных из
кожи южноамериканских лягушек. Биосинтез L-A. происходит в результате аминирования
и переаминирования пировиноградной к-ты или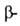 цекарбоксилирования
аспара-гиновой к-ты.
цекарбоксилирования
аспара-гиновой к-ты.
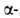 А. получают
аммонолизом
А. получают
аммонолизом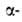 хлор(бром)пропионовой
к-ты. В спектре ЯМР
хлор(бром)пропионовой
к-ты. В спектре ЯМР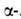 А.
величины хим. сдвигов (в м. д.) в D2O для протонов группы СН-3,778,
СН3-1,481. L-A. применяют для синтеза пептидов, в смеси с др.
аминокислотами-для парэнтерального питания.
А.
величины хим. сдвигов (в м. д.) в D2O для протонов группы СН-3,778,
СН3-1,481. L-A. применяют для синтеза пептидов, в смеси с др.
аминокислотами-для парэнтерального питания.
Впервые выделен из фиброина шелка в 1888, синтезирован А. Штреккером в 1850 омылением нитрила А., полученного взаимод. аммиаката ацетальдегида с HCN и НС1. Мировое произ-во L-A. ок. 130 т/год (1982).
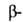 Алании
Алании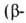 аминопропионовая к-та) Н2NСН2СН2СООН -кристаллы;
т.пл. 200°С; раств. в воде, плохо-в спирте; рКа СООН
и NН2 соотв. 3,6 и 10,19, рI-6,9. Структурный фрагмент кофермента
А, пантотено-вой к-ты, ансерина и карнозина. Биосинтез:
аминопропионовая к-та) Н2NСН2СН2СООН -кристаллы;
т.пл. 200°С; раств. в воде, плохо-в спирте; рКа СООН
и NН2 соотв. 3,6 и 10,19, рI-6,9. Структурный фрагмент кофермента
А, пантотено-вой к-ты, ансерина и карнозина. Биосинтез: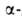 декарбоксилирование
аспарагиновой к-ты или расщепление пиримидиновых оснований через дигидроурацил.
Получают
декарбоксилирование
аспарагиновой к-ты или расщепление пиримидиновых оснований через дигидроурацил.
Получают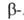 А.
действием избытка NH3 на акрилонитрил, акролеин или акриловую
к-ту; взаимод. гипобромита щелочного металла с сукцинимидом. Применяют
для приготовления буферных р-ров, синтеза пантотеновой к-ты и аналогов
биологически активных пептидов. В. В. Баев.
А.
действием избытка NH3 на акрилонитрил, акролеин или акриловую
к-ту; взаимод. гипобромита щелочного металла с сукцинимидом. Применяют
для приготовления буферных р-ров, синтеза пантотеновой к-ты и аналогов
биологически активных пептидов. В. В. Баев.


