АЗОТА ФТОРИДЫ, бесцв. газы со специфич. запахом (см. табл.). Термически неустойчивы (кроме NF3 и NOF), при 100-300°С разлагаются (NHF2 и NC1F2-взрываются): N2F4-сначала до NF2, затем до NF3 и N2; N2F2 -до F2 и N2 (выше 70°С); NHF2 - на N,F4 и NH4HF2; NClF,-Ha N2F4 и Сl2 или NF3, N2 и C12; NO2F- на O2 и NOF; NOF3-Ha F2 и NOF. Гидролизуются водой, причем NF3 и NHF2 раств. в воде и медленно гидролизуются в р-ре, N2F4 и N2F2 гидролизуются при нагревании. NOF и NO2F раств. в жидком HF с образованием гидрофторидов: NOF-3HF (т. пл. 1°С, т. кип. 95 °С), NOF-6HF (т. кип. 69°С), 2NO2F-7HF (т. пл. -28°С), NO,F-4HF (т. пл. -39°С), 4NO2F-21HF (т.пл. -67°С), 3NO2F-20HF (т. пл. -96°С).
А.ф.-сильные окислители. Взаимод. со мн. элементами, оксидами, солями, орг. и элементоорг. соединениями. Смеси Наиб. инертного A.ф.-NF3 с газами-восстановителями или парами Н2О при нагр. взрываются. А.ф. присоединяются к олефинам, с к-тами Льюиса образуют комплексные соед., содержащие катионы NF4+ N2F+ , N2F3+, NOF+2, NH2F+2 и др.
Методы получения А.ф.: NF3-электролизом расплавов NH4HF2-HF или взаимод. F2 с NH3 либо с NH4HF2; N2F4 - реакцией NF3 с С или металлами; NHF2 -фторированием водных р-ров мочевины с послед, гидролизом образовавшегося NH2NONF2 при 50-60°С; NC1F2 - взаимод. F2 с NaN3 в присут. NaCl или взаимод. F2 и С12 с NaN3; N2F2 - р-цией F2 с NaN3 или NHF2 с KF, а также как побочный продукт при синтезе NF3; NOF и NOF3 - взаимод. NO с F2; NO2F- взаимод. F2 с NO2 или NaNО2.
А.ф. применяют как окислители и фторирующие агенты; NOF и NO2F-перспективные р-рители (напр., в технологии ядерного топлива), NOF-низкотемпературный электролит; N2F4 и N2F2-перспективные окислители ракетного топлива.
СВОЙСТВА ФТОРИДОВ АЗОТА
|
Показатель
|
Трифторид азота
NF3 |
Тетрафтор-гидразин
N2F4 |
Дифтордиазии
N2F2 |
Нитрозил-
NOF |
Нитрилфторид NO2F
|
Трифтор-аминоксид NOF3
|
Дифторамин NHF2
|
Хлороди-фторамин NC1F2
|
|
транс- *цис-изомер изомер
|
||||||||
|
Т. пл, °С .......
|
-206,78
|
-161,5
|
- 172 выше -195
|
- 132,5
|
- 166,0
|
-160
|
-11,8
|
-190,5
|
|
Т. кип., °С .......
|
- 129.00
|
-74,2
|
-111,4 -105,7
|
-59,9
|
-72.4
|
-85
|
-23,3
|
-65,9
|
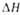 пл,
кДж/моль ..... пл,
кДж/моль ..... |
0,397
|
|||||||
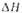
исп, кДж/моль |
11.6
|
15,7
|
14,2 15,3
|
19
|
18
|
16,1
|
24,9
|
17,4
|
|
Плотность жидкости, т/см3 .
|
1,643
(-154°C) |
1,454 (-74,2°C)
|
—
— |
1,326 (-59,9°С)
|
1,492
(-72,4°C) |
0,927 (-87,6°С)
|
1,373 (-23,6°C)
|
-
|
|
С°, ДжД.моль*К) . . . .
|
53,53
|
88,4
|
53,4 54,5
|
41,5
|
49,09
|
68,1
|
43,38
|
59.3
|
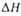 обр,
кДж/моль .... обр,
кДж/моль .... |
-131,7
|
-22
|
67,3 62
|
65,0
|
-109
|
-187
|
-103
|
17
|
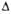 G0обр,
кДж/моль .... G0обр,
кДж/моль .... |
-84
|
79
|
140 139
|
-51
|
37
|
-49
|
54
|
|
|
S0298, Дж/(моль*К) .
. . .
|
260,7
|
317
|
262,0 266,3
|
248
|
259,3
|
277,6
|
252,7
|
284
|
*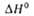 перехода
t/uc-формы в транс-форму 5,6 ± 1,0 кДж/моль.
перехода
t/uc-формы в транс-форму 5,6 ± 1,0 кДж/моль.
Помимо перечисленных известны и др. А. ф.-фторамины NH2F и ND2F, дихлорофторамин NC12F. Иногда к А.ф. относят также азид фтора N3F и нитроксифторид NO3F.
Лит.: Панкратов А. В., Химия фторидов азота, М., 1973; Jones
К., The chemistry of nitrogen, Oxf., 1975 (Pergamon texts in inorganic
chemistry, v. II). Э. Г. Раков.


